| 文字サイズ: |
標識リガンド結合アッセイ(総論)
目次
実験概要
実験の留意点
アッセイフォーマット
アッセイの種類
リガンド結合の概要
実験例
ヒントとよくある質問
実験概要
このアッセイでは、例えば受容体の性状解析などのために、目的の受容体を含む細胞または細胞膜への放射性標識リガンドの結合を測定します。放射性標識リガンドを使用して、飽和曲線の作成、競合実験、カイネティックス測定を実施することができます。
実験の留意点
放射性標識リガンドの選択には、以下の事項に留意する必要があります。
高い比放射能:
高比放射能を有する放射性標識リガンドが、本アッセイに非常に適しています。比放射能は、リガンドの分子あたりの放射能の量を示し、通常、リガンドのmmolあたりのBqの単位で示されます。125I標識リガンドは、最大の比放射能のものが使用される場合が多いです(例えば、1つの125I標識部位がある場合の最大比放射能は81.4TBq/mmol、2つの125I標識部位がある場合は162.8TBq/mmolとなっています。)。これは、バイアルに入っているリガンドのほぼすべての分子が標識されていることを示しています。3H標識化合物の場合、740GBq/mmol以上の比放射能を選んだ方がよいでしょう(3Hの最大理論比放射能は1.1TBq / mmol)。
低い非特異的結合:
疎水性リガンドは一般的に非特異的な結合が起こります。非特異的結合を減らすためには、BSA(Bovine serum albumin)でフィルターをコーティングすることが有効です。また、バッファー中にBSAまたは界面活性剤を添加する、あるいは塩濃度を上げることでも減少させることができます。放射性標識リガンドがシラン処理されたバイアルに入っている場合、リガンドが疎水性である可能性があります。
高い放射化学純度:
理想的には、90%を超える放射化学純度(標識率)であった方がよいでしょう。放射化学純度は経時的に低下していきます。
標的受容体に対する高い特異性:
リガンドが受容体に対して特異的であるほど、良いデータが得られます。また、目的の受容体を過剰発現する細胞や細胞膜を使用することで、内在的に発現している他の受容体の影響を減らすことができます。
安定性:
長期間にわたって放射性標識リガンドを使用する場合は、安定性が重要な要素となります。125I標識リガンドは一般的に製造日から1〜2ヶ月以内に使用します。また、3Hの場合は通常、製造日から3〜6か月以内に使用します。
放出する放射線:
3Hは、β線を放出するためシンチレーションカウンタで測定することができます。もし、ガンマカウンタしか施設にない場合は125I(β、γ線放出核種)標識リガンドを用いることでも測定が可能です。さらに、アッセイのフォーマットによりますが、125 Iは3 Hよりもβ線のエネルギーが高いため、FlashPlateアッセイを実施することができます。FlashPlateはシンチレータがプレート内に埋め込まれているため、125 Iで標識された放射性標識リガンドを用いることができます。SPAアッセイでは、3 Hまたは125 I標識リガンドを使用できます。
アッセイフォーマット
放射性標識リガンド結合アッセイは、以下のフォーマットがあり、一般的にはFiltrationアッセイを実施します。他にも、SPA(Scintillation proximity assay)またはFlashPlateアッセイでも実施できます。SPAおよびFlashPlateアッセイでは、洗浄手順が不要です。Filtrationアッセイでは、真空マニホールドまたはセルハーベスターを使用して未結合のリガンドを洗浄します。
| Filtrationアッセイ | SPA | FlashPlateアッセイ | |
| メリット | ・優れた分離技術 ・大容量でも実験可能 ・簡潔なアッセイステップ |
・洗浄ステップ不要 ・96ウェル、384ウェルフォーマットで実験可能 ・1日以内で実験可能 ・アッセイのばらつきが小さい |
・洗浄ステップ不要(ただし、必要に応じて洗浄することも可能)。 ・96ウェルフォーマットで実験可能 ・1日以内で実験可能 ・アッセイのばらつきが小さい ・ビーズが沈殿する可能性がない。 |
| デメリット | ・洗浄手順があるため、アッセイのばらつきが大きくなる可能性がある。洗浄ステップや回数を最適化が必要。 ・他のアッセイより多くの放射性廃棄物が発生する。 ・ハイスループットでは実行できない。(96ウェルフォーマットは可能)。 |
・バックグラウンドが問題になることがあり、アッセイの最適化が必要になる場合がある。 | ・バックグラウンドが問題になることがあり、アッセイの最適化が必要になる場合がある。 |
アッセイの種類
Filtrationアッセイ
フィルタープレートアッセイについて、必要な材料や最適化の方法についてはこちらを参照してください。
フィルタープレートアッセイでは、まずアッセイプレートに放射性標識リガンドを結合させます。次に、セルハーベスター(または真空マニホールド)を用い、フィルターを通して濾過します。次いで、フィルターを洗浄して未結合の放射性標識リガンドを除去し、フィルターマットまたはプレートを乾燥させます。その後、シンチレーションカクテルを加え、適切な検出器で読み取ります。
SPA
SPA(Scintillation proximity assay)について、必要な材料や最適化の方法についてはこちらを参照してください。
SPAは、さまざまな生物学的プロセスの解析を目的として実施される、迅速かつ高感度な技術です。SPAは分離ステップを経ることがなく、オートメーション化が可能なため、特にハイスループットスクリーニングに適しています。
FlashPlateアッセイ
FlashPlateアッセイについて、必要な材料や最適化の方法についてはこちらを参照してください。
FlashPlateへの細胞膜の結合様式は、一般的な細胞培養用のマイクロプレートと同様であり、標準的なプレートコーティング法を用いています。標的受容体または受容体膜をFlashPlateウェルにコーティングまたは結合させた後、放射性標識リガンド、コントロール物質、および化合物を添加します。放射性標識リガンドから放出されたエネルギーは、FlashPlateに埋め込まれたシンチレータと相互作用し、検出可能なシグナルが生成されます。結合していない放射性標識リガンドは、シンチレータを活性化しませんので、それらの分離工程は不要です。
リガンド結合の概要
基礎的な用語
結合親和性:
リガンドが受容体に結合する強さ。通常、リガンドの結合親和性はKdとして表されます。Kd値が低いほど、親和性が高いことを示します。
特異性:
(類似する受容体に対する)特定の受容体へのリガンドの結合選択性。
Kd値:
受容体の50%が放射性標識リガンドによって占められる濃度。
リガンドの薬理学的な分類
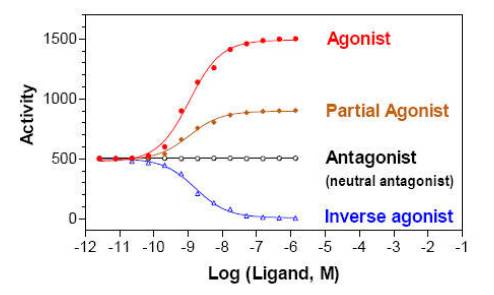
Agonist(アゴニスト):
受容体に結合して活性化し、反応を引き起こすリガンド
Partial Agonist(パーシャルアゴニスト):
受容体に結合して、アゴニスト以下の反応を生じるリガンド
Antagonist(アンタゴニスト):
受容体を活性化しないが、受容体に結合することができるリガンド。アンタゴニストは競合的にアゴニストの効果を阻害します。
Inverse agonist(インバースアゴニスト):
受容体に結合し、活性を基礎レベル以下に低下させるリガンド
実験例
飽和曲線実験
受容体の量を一定にした状態で、種々の濃度の放射性標識リガンドとの結合平衡を測定する実験です。飽和曲線を使用して、Bmax(受容体密度を示す最大結合部位数)とKd(リガンドの受容体への結合親和性)を決定することができます。
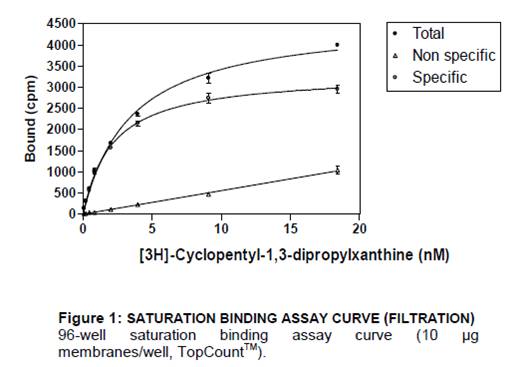
飽和曲線実験で測定できる結合様式
Total(全結合):
放射性標識リガンドだけが存在する場合の結合(cpm)の増加分であり、受容体への特異的結合と非特異的結合を足したものになります。
Non specific(非特異的結合):
過剰量の非標識リガンド存在下での放射性標識リガンドの結合分であり、放射性標識リガンドの非特異的な結合となります。
Specific(特異的結合):
全結合から非特異的結合を引いたもので、受容体への特異的な結合になります。
競合実験
さまざまな濃度の非標識競合化合物(アゴニストやアンタゴニスト等)を添加し、一定濃度の放射性標識リガンドの結合を測定します。競合曲線を使用して、受容体に対する競合化合物の親和性を決定することができます。IC50およびKiは測定データから導き出すことができます。
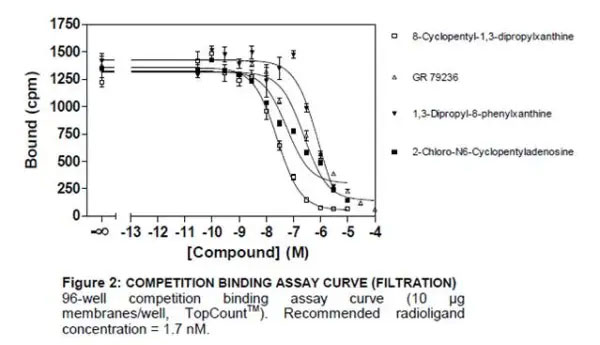
競合実験で測定できる結合様式
IC50:
放射性標識リガンドの半分(50%)を置換する競合化合物の濃度。
Ki(結合阻害定数):
競合する物質の作用強度であり、値が小さいほど阻害作用が強いことを示します。
*放射性標識リガンドの濃度を変えると、化合物のIC50のシフトが観察されますが、Kiは変化しません。
カイネティクス実験
種々の時間における結合レベルを測定して、放射性標識リガンドの結合速度定数(Kon)および解離速度定数(Koff)を決定することができます。解離定数(Kd)との関係は下記の式で表されます。
Kd = K(off)/K(on)
ヒントとよくある質問
ヒント①
以下の特性を持つ放射性標識リガンドを選択しましょう。
・高い比放射能(3Hの場合、>740GBq/mmol)
・低い非特異的結合(疎水性リガンドは一般により高い非特異的結合を示します。)
・高い放射化学純度(> 90%)
・受容体に対するリガンドの高い選択性
・安定性(放射性標識リガンドを長期間にわたって使用する必要がある場合は、安定性が重要となる可能性があります。125I標識リガンドは通常、製造日から1〜2か月以内に使用します。3H標識リガンドは通常、製造から3-6か月以内に使用します。)
ヒント②
放射性リガンドのデータをプロットするときは、希釈率から計算された濃度ではなく、実験的に求めたワーキング溶液の濃度を使用することをお勧めします。一部の放射性リガンドは、希釈チューブの壁に付着します。 反応溶液中の放射性リガンドの真の濃度を決定することが重要です。ワーキング溶液の放射性標識リガンドの濃度を実験的に測定するために、チューブから数マイクロリットルをピペットで取り出して、フィルターマットの上にスポットし、さらに結果をクロスチェックできるように、この溶液の1/10希釈をスポットしましょう。これらサンプルのdps(1秒あたりの崩壊数=Bq)を決定します。
その後、ご自身が使う試薬に記載の比放射能の数値を利用し、Bqからmolへ変換します。リガンド濃度を決定するには、molをフィルターマットにスポットした量で割ります。
よくある質問
飽和曲線の作成のためにはどのような濃度の放射性標識リガンドを使用すればよいですか?
通常、Kdより3〜5倍高い、もしくは低い濃度の範囲をお勧めします。最高濃度はKdの10倍としておきます。
競合実験のためにどのような濃度の放射性標識リガンドを選択すべきですか?
放射性標識リガンドは、通常はKd値以下の濃度で使用します。比放射能が低い場合は、Kd値を超える濃度を使用できますが、飽和濃度以上にしないでください。
飽和曲線の非特異的結合を決定するためにどのような種類のリガンドを使用すればよいですか?
A.通常、自身が着目している放射性標識リガンドとは異なるリガンドを選びます。放射性リガンドの受容体への特異的結合のみを置換したいので、受容体結合部位に対して高い親和性を持ち、非特異的結合部位に対して低い親和性を持つリガンドを選択する必要があります。















