| 文字サイズ: |
SPA(Scintillation proximity assay)
目次
実験概要
主な準備物
プロトコル概要
アッセイの最適化
ヒントとよくある質問
引用文献
実験概要
Scintillation proximity assay(SPA)は、受容体の動態、飽和結合の解析、または放射性標識リガンドの阻害剤を解析できることができます。本アッセイでは、SPAビーズの表面にカップリング法を介して放射性標識リガンドが結合する受容体を直接固定化します。固定化された受容体に結合した放射性標識リガンドは、SPAビーズ内のシンチレータに近接しているため、シグナルを放出し検出されます。受容体に結合していない放射性標識リガンドは、SPAビーズから距離があるためエネルギーを伝えられず、シグナルとしては検出されません。
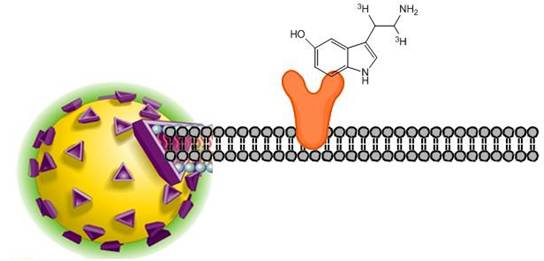
SPAのイメージ図
SPAでは以下のサンプルをアッセイに用いることができます。
・組織からの細胞膜サンプル
・培養細胞からの細胞膜サンプル
・全細胞
・精製された可溶性受容体
・組織および培養細胞からの可溶性受容体
主な準備物
・可溶性受容体、または目的の受容体を発現する細胞膜
・放射性標識リガンド
・非標識リガンド(非特異的結合の測定のため)
・必要に応じたリガンドおよび試験化合物
・SPAビーズ
・検出機器
本アッセイに使用されるSPAビーズのタイプとコーティングについて
・本アッセイは、Wheat Germ Agglutinin(WGA)でコーティングしたSPAビーズを使用します。WGAは、細胞膜に存在するN-acetyl-s-D-glucosaminyl残基、N-acetyl-s-D-glucosamine oligomers、および糖タンパクに結合することで、目的の受容体を発現する細胞膜を捕捉します。
・WGA処理の際に合わせて、または単独でポリエチレンイミン(PEI)を使用すると、非特異的結合をさらに減らすことができます。
・正に帯電したポリエチレンイミン(PEI)でPVT-WGA SPAビーズを処理すると、SPAビーズ表面の非特異的結合部位がブロックされます。PEI処理を行った2つのタイプのSPAビーズがあります。
PVT-WGA-PEIタイプA:WGAをPVT SPAビーズに結合させる前にPEI処理しています。
PVT-WGA PEIタイプB:WGA結合後にPEI処理しています。
タイプAおよびBは、SPAビーズへの放射性標識リガンドの非特異的結合に関して異なる特性を示します。どちらのSPAビーズを使用するかを検討いただけるよう、両方のビーズタイプがキットに含まれています。細胞膜タンパク質に対する両タイプの結合能力は、SPAビーズ1mgあたり10〜30μgです。
・Poly-L-Lysineは、負に帯電した細胞膜に使用されます。
・可溶性受容体は、受容体に特異的な抗体を介してSPAビーズ上に捕捉させることが可能です。
・受容体タンパク質をビオチン化し、ストレプトアビジンでコーティングされたビーズに捕捉させることも可能です。
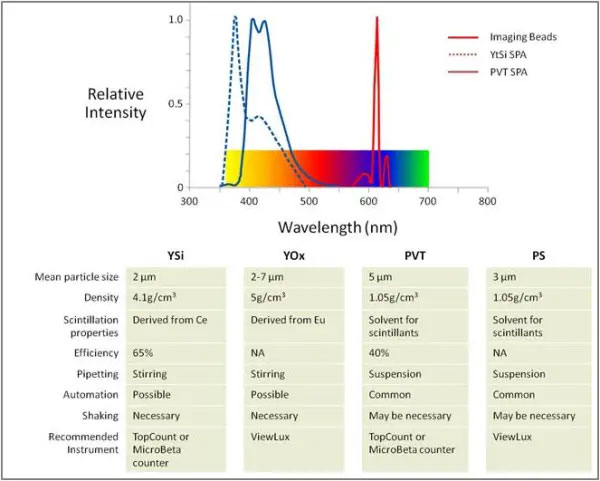
SPAビーズのコアビーズのタイプ
プロトコル概要
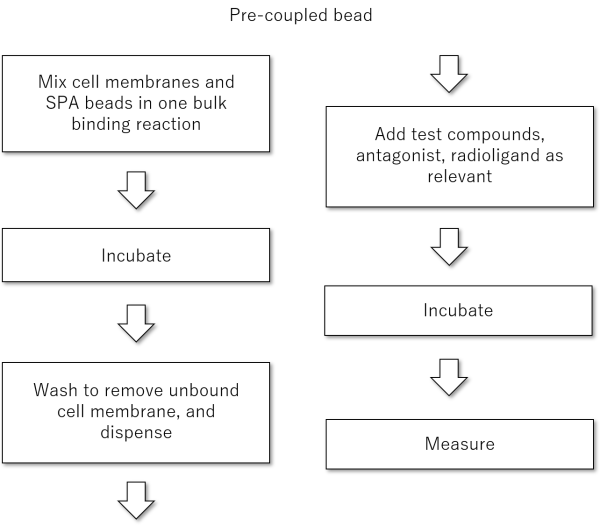
Pre-coupledフォーマット
SPAビーズと細胞膜を事前に混合します。その後、過剰な細胞膜を洗浄により除去します。ただし、SPAビーズに結合したすべての受容体がリガンドに結合できるとは限りません。
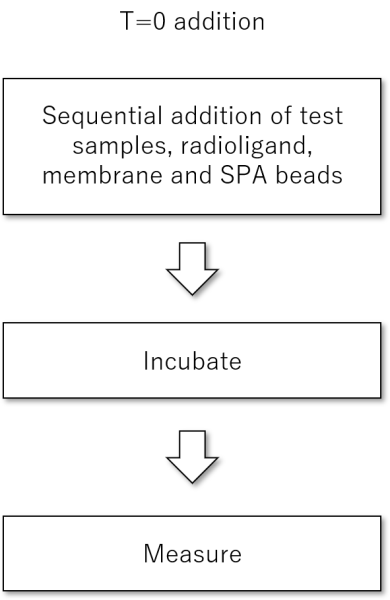
Simultaneous addition( "T = 0″)フォーマット
まず、リガンド、受容体、SPAビーズを順次添加していきます。本フォーマットと以下で説明するDelayed additionフォーマットは、細胞膜とSPAビーズの量を簡単に最適化することができます。また、すべての細胞膜を完全に捕捉するためには、余分にSPAビーズを添加する必要があります。平衡に達するのに必要なインキュベーションの時間は、Delayed additionフォーマットと比較すると若干長くなる場合があります。
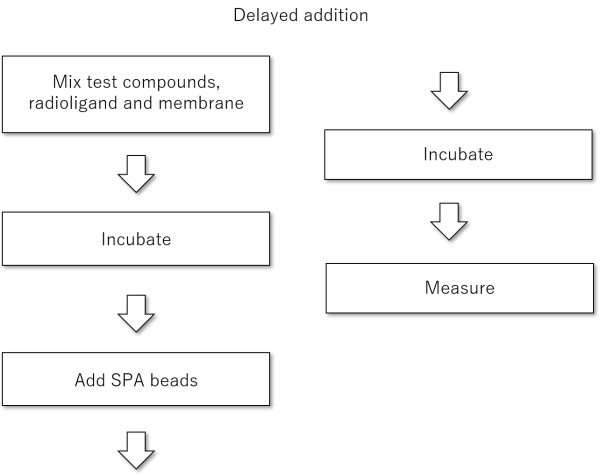
Delayed additionフォーマット
リガンドを受容体に結合させた後にSPAビーズを使用するため、SPAビーズの影響を少なくすることができます。リガンドと受容体が結合した後にビーズを追加し、その後30〜40分でSPAビーズと細胞膜が結合します。
アッセイの最適化
アッセイバッファーの最適化
受容体を活性化させるために、CaCl2、MgCl2、NaCl等を添加する必要があります。pHは、通常7.0〜7.5で使用します。一般的に使用されるバッファーには、25 mM〜100 mMのTrisまたはHEPESが含まれます。プロテアーゼ阻害剤は、膜タンパク質の分解を防ぐために必要となる場合があります。
以下は、細胞膜受容体への放射性標識リガンドの結合を改善する条件、およびSPAビーズへの放射性標識リガンドの結合を減少させるための条件になります。場合によっては、他の試薬が必要になる場合があります。
| Agents which reduce NSB(Non-Specific Binding) | Conc. ranges |
| BSA | 0.05% - 0.3% |
| Ovalbumin | 0.05% - 0.3% |
| NP-40 | 0.05% - 0.3% |
| Triton X-100 | 0.05% - 0.1% |
| Gelatin | 0.05% - 0.3% |
| Polyethylenimine | 0.01% - 0.1% |
| CHAPS | 0.5% |
| Tween-20 | 0.05% - 0.1% |
| Fetal bovine serum (FBS) | up to 10% |
| Antioxidants/Reducing Agents | concentrations |
| Ascorbic acid | 0.1% |
| Pargyline | 10 µM |
| DTT | 1 mM |
| Reduce SPA settling effects | Concentrations |
| Glycerol | 10-20% |
| Glucose | 10 mM |
| Polyethylene glycol(PEG) | 5-10% |
| Divalent Cations | Conc. ranges |
| Magensium (Mg2+) | 1 mM - 10 mM |
| Sodium acetate | 10 mM - 50 mM |
| Calcium (Ca2+) | 1 mM - 10 mM |
| Zinc (Zn2+) | 10 µM - 50 µM |
| Other buffer additives | Conc.ranges |
| NaCl | 100 mM - 150 mM |
| KCl | 5 mM - 80 mM |
| TRIS | 10 mM - 50 mM |
| HEPES | 5 mM - 100 mM |
| Phosphate buffer | 20 mM |
| pH | 7.0 - 8.0 |
| Aprotinin | 500 units/ml |
| EDTA | 0.5 mM - 5 mM |
アッセイフォーマットの選択
Pre-coupledフォーマット:
アッセイの前に細胞膜をSPAビーズに結合させます。細胞膜とビーズの比率の最適化により、非特異的結合(NSB;Non-Specific Binding)が少なくなりシグナル/ ノイズ比が向上します。
Simultaneous addition( "T = 0″)フォーマット:
テストサンプル、放射性標識リガンド、細胞膜、SPAビーズを順次添加します。すべての細胞膜を捕捉するためには余分なビーズを添加することが必要です。
Delayed additionフォーマット:
SPAビーズを添加する前に、テストサンプル、放射性標識リガンド、および細胞膜を平衡化させます。デメリットは、SPAビーズを添加すると容量が増加するため、他の成分の濃度が低下し平衡状態に影響を与える点です。
細胞膜/SPAビーズの最適化
重要なポイントとしては、シグナル/ノイズ比を改善するために、細胞膜/ビーズ比および量を最適化することです。
各フォーマットでは、一定量の放射性標識リガンドを添加しますが、その量は、その受容体と放射性標識リガンドの親和性に依存するので、Kd値付近の濃度にします。
125Iリガンドの場合、通常1ウェルあたり0.5〜2.0 mgのビーズ重量、1〜100μgの細胞膜タンパク質量でアッセイします。また、3Hリガンドの場合は、1ウェルあたり最大4.0 mgのビーズ重量、10〜100μgの細胞膜タンパク質量です。これらの違いは、放射性標識リガンドの比放射能に関係しています。
リガンド濃度の最適化
リガンドの濃度を変化させることで得られるシグナルは、簡単に最適化することができます。
最適化の目的は次のとおりです。
・S / N比を最大化するため
・シグナルを増加させるため(受容体に対するリガンドの親和性が低い場合)
*上記は放射性標識リガンドの量を増やすか、アッセイ容量を減らすことで解決できますが、結果として非特異的結合のnon-proximity effect(NPE)が増える可能性があります。また、感度も影響を受ける可能性があります。
非特異的結合(NSB)の確認
細胞膜存在下での放射性標識リガンドがSPAビーズに結合したカウントを測定して、NSBを決定します。
non-proximity effect(NPE)の確認
非結合の放射性核種やリガンドから生成されたシグナルを確認します。
カウントウィンドウの決定
タイムコースで実験し、平衡に達するまでのインキュベーション時間と、平衡時のカウントの安定性を確認します。
アッセイの妥当性の確認
・目的の受容体を発現しない細胞株または組織を使用して、コントロール実験を行います。
・目的の受容体と既知のリガンドで競合結合曲線を作成し、IC50 / Ki値を比較します。
・飽和結合実験を行い、Kd値を比較します。
・CV値またはZ '値によりアッセイを検証します。
ヒントとよくある質問
ヒント
・受容体の濃度が高い実験において、受容体へのリガンドの親和性が高い(<10 mM)場合、3Hまたは125I標識リガンドを使用します。しかし、親和性が低い場合(10 nM〜10μM)、125Iの使用が適しています。
・比放射能が低い3H標識リガンド(0.74〜2.96TBq/mmol)を使用する場合、2 pmol/ mg(受容体タンパク質/膜タンパク質)以上の受容体が発現している必要があります(細胞あたり500,000受容体)。
・比放射能が高い(〜74TBq/mmol)125I標識リガンドを使用する場合、約200 fmol/ mg(受容体タンパク質/膜タンパク質)以下の受容体の発現でも実験することができます(細胞あたり50,000受容体)。
・プロテアーゼ阻害剤の添加は、受容体またはリガンドが分解されるのを防ぎます。
・グリコシル化リガンドはWGA-PVTビーズに非特異的に結合します。
・ポリ-L-リジンビーズは、負に帯電した細胞膜と正に帯電したビーズ間の静電相互作用によって結合します。相互作用は非特異的であるため、負に帯電したリガンドがこれらのビーズに結合します。
・WGA-PVTビーズの結合能力はビーズ1 mgあたり細胞膜タンパク質10〜30μgです。
・ポリ-L-リジンビーズの結合能力はビーズ1 mgあたり細胞膜タンパク質10μgです。
・インキュベーション時間は、アッセイチューブまたはプレートを攪拌することで短縮できます。WGA-PVTビーズを使用するアッセイでは、撹拌するのが望ましく、ポリ-L-リジンビーズを使用するアッセイには撹拌が不可欠です。
・細胞膜とWGA-PVTおよびPL-YSビーズの結合は短時間で完了します(20〜60分)。
よくある質問
SPAに適した受容体は何ですか?
全細胞、膜調製物、精製または可溶性受容体をSPAアッセイで使用できます。受容体とビーズの組み合わせについてはよく検討する必要があります。例えば、WGAでコーティングされたSPAビーズは、細胞質あるいは核内の受容体等への結合には適切ではありません。
SPAビーズと細胞膜はどれくらいの濃度で使用すればよいですか?
最初に各々の濃度で組み合わせテストを行い、アッセイに使用する細胞膜とSPAビーズの最適量を決定します。以下は、アッセイで使用する細胞膜とビーズの比率を最適化するためのヒントになります。
・一定の濃度と容量の放射性標識リガンドを使用します。
・NSB(Non-Specific Binding)を確認するために、様々な濃度のSPAビーズで細胞膜無しのコントロール実験を行います。
・テストする細胞膜とSPAビーズの組み合わせでB0、NSB用のチューブを準備します。125I標識リガンドの場合は、ウェルあたり0.25〜2 mgのSPAビーズ、および各ビーズ濃度あたり5μg〜50μgの細胞膜を用意します。3H標識リガンドの場合は、ウェルあたり0.5〜4 mgのSPAビーズと5μg〜100μgの細胞膜とします。
・Pre-coupledフォーマットの場合、細胞膜とビーズを最適化する手順として、一定量のビーズに様々な濃度の細胞膜を結合させます。一定量の放射性標識リガンドとサンプル(0.5mgまたは1mg)でテストして、全結合および非特異的結合を決定します。
・完全に平衡化させた状態で測定し、特異的または非特異的結合を計算します。
・Filtrationアッセイとは異なり、SPAでは平衡に達するまでに数時間を必要とします。
・アッセイした各ビーズ量について、x軸に細胞膜/受容体の量を、y軸に特異的結合数をプロットします。各曲線は、プラトーに達する必要があります。各曲線のNSBを調べて、最大のS / N比が得られるビーズの量を決定します。
細胞膜をSPAビーズに結合させるにはどうすればよいですか?
細胞膜は、WGAでコーティングされたSPAビーズ、およびポリ-L-リジンビーズに結合させることができます。WGAは、細胞膜の糖タンパク質と糖脂質に結合します。ポリ-L-リジンは負に帯電した細胞溶解液中の分子に結合します。
WGAコーティングビーズの結合容量は、ビーズ1mgあたり膜タンパク質10〜30μgです。ポリ-L-リジンビーズは、細胞膜に対して選択性が低いため、ビーズ1 mgあたり10μgの膜タンパク質に結合します。
細胞膜とビーズは、順次添加する場合や(Simultaneous addition( "T = 0″)フォーマット)、事前に結合させた溶液として添加する場合があります(Pre-coupledフォーマット)。または、細胞膜とリガンドが平衡化した後に添加する場合もあります(Delayed additionフォーマット)。
すべての細胞膜がビーズに結合するように、細胞膜とビーズの比率を最適化する必要があります。SPAビーズに細胞膜が結合していない場合、放射性標識リガンドのシグナルは検出されません。
アッセイを行う前に、細胞膜をビーズに結合させることはできますか?
細胞膜またはSPAビーズを溶液に添加する前に、事前に細胞膜をビーズに結合させておくことができます。
細胞膜とビーズの量は最適化する必要がありますが、手順としては、ビーズを使用して細胞膜を2〜8℃で1〜4時間穏やかに振とうさせます。次に、ビーズを沈降させるか、1000 x gで5〜10分間、4℃で穏やかに遠心分離してペレット化します。ビーズペレットをアッセイバッファーで2回洗浄して、結合していない細胞膜を除去してからバッファーに使用濃度まで懸濁します。
リガンドが受容体に結合した後、細胞膜をSPAビーズに結合させることはできますか?
Delayed additionフォーマットで可能です。
添加するビーズは、アッセイウェルのすべての細胞膜に結合するのに十分な量を用意します。溶液を添加する際に容量が増加するため、リガンドの結合における平衡状態がシフトします。そのため、反応を再平衡化するための時間が必要になる場合があります。細胞膜は約30分でビーズに結合します。
結合していない細胞膜を取り除く必要がありますか?
アッセイでは、すべての細胞膜がビーズに結合していることが重要です。ビーズに結合していない細胞膜に放射性標識リガンドが結合している場合は、シグナルとして検出されません。
Simultaneous addition("T = 0″)、Delayed additionフォーマットの場合、細胞膜と完全に結合させるために、余分にビーズを添加します。
Pre-coupledフォーマットの場合、事前の結合処理後にビーズを洗浄して、未結合の細胞膜を除去することが不可欠です。
細胞膜はビーズから脱落しますか?
一旦、細胞膜がビーズと結合した後にビーズ表面から脱落することはほとんどありませんが、プロテアーゼ活性または細菌のコンタミネーションにより、受容体タンパク質が分解される可能性があります。インキュベーション時間を長く設定する場合は、プロテアーゼ阻害剤と抗菌剤の使用を検討してください。
ビーズへの細胞膜の結合を妨げるものは何ですか?
WGAコーティングされたビーズの場合、グリコシル化された化合物等(細胞溶解物に存在する可能性があります)が、WGAに存在するN-アセチル-グルコサミンと競合する可能性があります。
抗体結合ビーズが使用されている場合、特定の抗受容体抗体以外の抗体がポリクローナル抗体調製物に存在する可能性があります。
ビオチン化受容体に対してストレプトアビジンビーズを使用する場合、受容体調製物に不純物が無いことや、非受容体タンパク質がビオチン化反応でビオチン化され得ることが重要です。
細胞膜をビーズに結合させる場合、バッファーのpHとイオン強度は重要ですか?
フォーマットによって、pHとイオン強度が重要になる場合があります。抗体を用いる場合は、pHとイオン強度に影響を受ける可能性があります。さらに受容体タンパク質はpHの変化によって影響を受けます。
SPAにはどのフォーマットを使用すればよいですか?
アッセイフォーマットには以下の3つがありますが、それぞれ独自の利点があります。一般に使用されている条件で最初にテストすることをお勧めします。
最良のシグナル/ノイズ比を決定するために、3つの形式を同時に試すことが有効です。これら3つの形式の詳細については、上記のセクションを参照してください。
| フォーマット | 利点 |
| Pre-coupled to SPA bead | NSBの軽減 |
| Time zero (T=0) addition of SPA beads | 自動化が容易 |
| Delayed addition of SPA beads | 最適なリガンド/受容体相互作用 |
Pre-coupledフォーマットの利点は何ですか?
ビーズと細胞膜のミックスを単一の試薬として添加できるため、分注回数が減り、時間を短縮できます。
さらに結合前のステップで、バックグラウンドを減らすことができます。これは、ビーズの表面が細胞膜で覆われることにより、放射性標識リガンドとビーズとの非特異的な相互作用する面積が減少するためです。
また、細胞膜はすでにビーズに結合しているため、余分なビーズを追加する必要はありません。過剰にビーズを追加すると、すべての細胞膜が確実に捕捉されるため、最大のシグナルが得られますが、NSBとNPEが増加する原因となります。
Delayed additionフォーマットの利点は何ですか?
リガンドが受容体に結合した後、アッセイにビーズを追加することで、ビーズによる受容体-リガンド結合の阻害が起こりません。
このフォーマットのインキュベーション時間は、Time zero (T=0) additionフォーマットよりもわずかに短い場合があります。受容体-リガンド結合が平衡化したら、ビーズを追加し、ビーズが確実に膜を捕捉するまでさらに30〜40分かかります。
Time zero (T=0) additionフォーマットの利点は何ですか?
このフォーマットでは、リガンド、受容体、およびビーズが個別に添加されます。
試薬の添加は簡単で、Filtrationアッセイに似ています。アッセイの前にビーズと細胞膜を処理する必要がないため、試薬をアッセイの当日に融解・調整して使用することができます。
細胞膜とビーズの量を個別に設定できるため、細胞膜とビーズ比の最適化が簡単です。また、アッセイで細胞膜を完全に捕捉するには、余分なビーズが必要になります。
最も一般的に使用されている形式はどれですか。
調整が簡単なため、Time zero (T=0) additionフォーマットが最も一般的に使用される形式です。
これらの3つのフォーマットで実験を行うと同じ結果が得られますか?
すべてのアッセイに適用できる一般的なプロトコルはありませんので場合によっては異なる結果が得られる場合があります。
異なる結果が得られた場合は、経験的に解決するのがよいでしょう。たとえば、ビーズ表面に付着する放射性標識リガンドについて、Pre-coupledフォーマットでは、放射性標識リガンドからビーズ表面を覆い隠すことにより、バックグラウンドを減らすことができます。
また、ビーズがリガンド-受容体結合を阻害している場合は、Delayed additionフォーマットが適するかもしれません(リガンド-受容体結合中にビーズが存在しないため)。
non-proximity effect(NPE)とは何ですか?
NPEは、放射性標識リガンドまたはビーズが、放射線からシグナルを引き出すのに十分な濃度である場合に発生します。これは、リガンド-受容体の相互作用、またはビーズとの非特異的相互作用を介して発生します。そのため、ビーズに結合していない場合でも発生する可能性があります。
一般に、NPEで発生するシグナルは線形関数であり、各試薬の濃度に比例します。したがって、シグナルと感度を最大化し、NPEとコストを最小限に抑えるためには、放射性物質とビーズの最適化(濃度を調整)が必要です。
ビーズへの非特異的結合(NSB)とは何ですか?
ビーズへのNSBにより発生するシグナルは、ビーズに付着した放射性物質に起因し、ビーズに付着した受容体との特異的な相互作用によるものではありません。
ビーズへのNSBの発生要因は、緩衝液と適切なビーズタイプの選択により低減することができます。ビーズへのNSBは、細胞膜受容体に対するNSBとは異なります。
通常のSPAにおいて、NSBはビーズ及び受容体への非特異的結合の合計になります。NSBは、細胞膜受容体の非存在下かつ過剰濃度の競合物質の存在下で決定することができます。















