| 文字サイズ: |
Filtrationアッセイ
目次
実験概要
主な準備物
プロトコル概要
プロトコル詳細
アッセイの最適化のために考慮する項目
その他の情報
ヒント
トラブルシューティング
引用文献
実験概要
本アッセイは、受容体の特徴を解析することや、放射性標識リガンドの特異的受容体結合に対する特定の化合物の阻害能を測定することで潜在的な医薬品候補化合物を評価するために利用されます。
受容体とリガンドの結合が平衡状態に達した後、真空マニホールドまたはセルハーベスターを使用して受容体サンプルをろ過することによって、受容体-リガンド複合体から過剰な遊離リガンドを速やかに分離することができます。フィルターは、一般的にガラス繊維フィルターが使用されています。本アッセイは、細胞全体にも使用できますが、通常は細胞膜を使用して行われます。
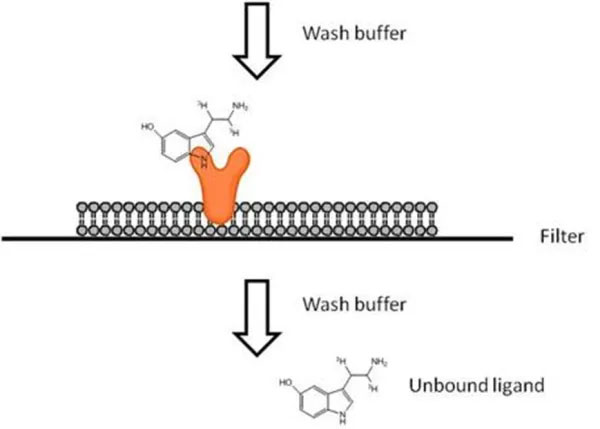
主な準備物
フィルターマットと真空マニホールドを使用する場合
・目的の受容体を発現している細胞膜
・放射性標識リガンド
・コントロールとしての非標識リガンド(非特異的結合を計測するため)
・必要に応じたリガンドおよび試験化合物
・フィルターマット
・シンチレーションカクテル
・真空マニホールドまたはセルハーベスター
・検出器
セルハーベスター付きのUniFilterプレートを使用する場合
・目的の受容体を発現している細胞膜
・放射性標識リガンド
・コントロールとしての非標識リガンド(非特異的結合を計測するため)
・必要に応じたリガンドおよび試験化合物
・シンチレーションカクテル
・セルハーベスター
・検出器
プロトコル概要
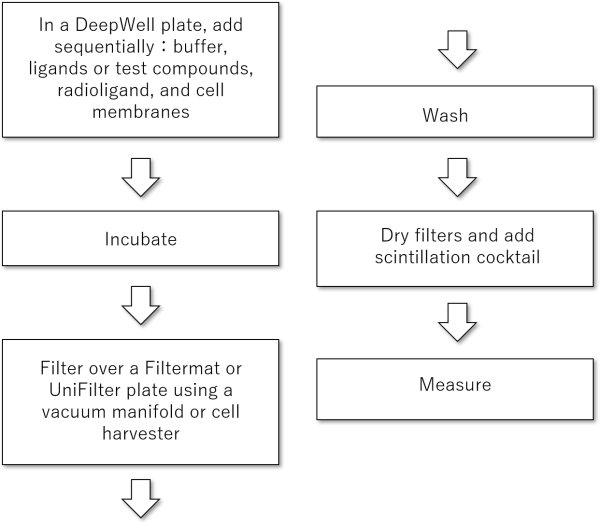
プロトコル詳細
ポリエチレンイミン(PEI)コーティングフィルタープレート
PEIでのフィルタープレートの処理により、フィルターへのリガンドの結合を低減することができます。PEIはガラス繊維フィルターの負電荷を中和するカチオン性ポリマーです。
PEIでコーティングする方法
1、0.1~0.5%のPEIに30~60分浸す(4℃)。
2、PEIを除去し、冷やしたバッファーで洗浄する。
*担体タンパク質、血清、または界面活性剤による処理によっても、フィルタープレートへのリガンドの結合を最小限にできます。事前にBSAでコーティングすることでも、疎水性リガンドおよび化合物がプラスチック表面へ結合するのを減少させることができます。
アッセイの最適化のために考慮する項目
・1ウェルあたりの細胞膜量
・結合緩衝液の最適化:緩衝液はあらゆるリガンド結合アッセイにおいて重要な要素となります。塩濃度、キャリアタンパク質の濃度、ならびに緩衝能および緩衝液の種類を最適化する必要があります。新しい緩衝液を使用する場合、事前に既知のリガンドを用いてアッセイが実行できるか確認しておきます。
・インキュベーション時間と温度:結合平衡は温度と時間に依存します。
・洗浄バッファーの最適化
・洗浄ステップ数
・標準化合物での用量−反応曲線の評価
その他の情報
NIHのアッセイガイダンス - フィルターベースおよびSPAベースのリガンド結合アッセイに関する情報が掲載されています。
ヒント
・リガンドの濃度は、各希釈液サンプルを測定し、dpmをモル濃度に変換することによって決定します。正確に希釈系列を調製することは、EC50およびIC50の値に影響します。
・放射性標識リガンドは、チューブ、ピペットチップ、アッセイプレートまたはフィルターなどに非特異的に結合します。これはリガンド量の減少につながる可能性があります。非特異的な結合を調べるには、細胞膜なしで実験を行います。それにより、放射性標識リガンドがアッセイのどの工程で失われているかを調べることができます。
・シンチレータを添加する前にフィルターが完全に乾いていないと、フィルター内に存在する残留水がシンチラントと相互作用して計数効率が低下する可能性があります。乾燥したフィルターは、湿ったフィルターよりも大きなシグナルが得られるので、相対的にシンチレータの量が少なくて済みます。ただし、フィルターを完全に乾燥させるには時間や手間がかかるため、スクリーニング用途には不向きです。そのような場合は、湿ったフィルターと互換性のあるシンチレータカクテルを使用してください。
・シリコン処理チューブおよびピペットチップの使用は、プラスチックへのリガンドの吸着を防ぎ、リガンド量の減少を防ぐことができます。
トラブルシューティング
| 問題 | 原因 | 解決策 |
| 非特異的結合が高い場合 | 細胞膜調整の失敗 | 新しい細胞膜を調整してください。 |
| 放射性/非標識リガンドの分解 | 新鮮なロットまたは新たに調製したリガンドを使用してください。 | |
| 非特異的結合しやすいリガンド | バッファーに担体分子(BSAまたはゼラチン)を添加してください。 | |
| フィルター | 担体分子を含む結合バッファーにあらかじめ浸しておく、またはフィルターをPEIでコーティングする必要があります。 | |
| ポンプの問題 | 機器を確認してください。 | |
| 洗浄が不十分 | バッファーの組成と容量を調整してください。 | |
| 特異的結合がみられない場合 | 細胞膜調整の失敗 | 新しい細胞膜を調整してください。 |
| 放射性標識リガンドの分解 | 新鮮なロットまたは新たに調製したリガンドを使用してください。 | |
| 非特異的結合しやすいリガンド | バッファーに担体分子(BSAまたはゼラチン)を添加してください。 | |
| ポンプの問題 | 機器を確認してください。 | |
| フィルターバッファーまたは洗浄バッファーの組成 | 組成を確認し、アッセイに最適化されていることを確認してください。 | |
| 検出機器でのカウント数が少ない場合 | 細胞膜調整の失敗 | 新しい細胞膜を調整してください。 |
| 放射性標識リガンドの分解 | 新鮮なロットまたは新たに調製したリガンドを使用してください。 | |
| 細胞膜または放射性標識リガンドの濃度が低すぎる | 濃度を上げます。 | |
| 非特異的結合しやすいリガンド | バッファーに担体分子(BSAまたはゼラチン)が必要な場合があります。 | |
| ガラス製品またはプレート | 一部のプラスチック製のプレート、チューブ、またはチップは、放射性/非標識リガンドの非特異的結合の原因となる可能性があります。 これらを実験前に確認しておきます。 | |
| アフィニティに変化が見られた場合 | 放射性標識リガンドの使用期限切れ | 放射性標識リガンドの新鮮なロットを使用してください。 |
| 非標識リガンドの分解 | 新たに調製したリガンドを使用してください。 | |
| 非特異的結合しやすいリガンド | バッファーに担体分子(BSAまたはゼラチン)が必要な場合があります。ガラス製品への高い非特異的結合等。 | |
| リガンドの不足 | (競合実験においては)アッセイ容量の増加、細胞膜の量の減少、または放射性標識リガンド濃度の増加。 | |
| 実験結果のばらつき | 非特異的な結合、または不均一な細胞膜の調製 | 18Gのニードルを付けた1mlシリンジに細胞膜溶液を通し均一にする。 |
| 非特異的結合しやすいリガンド | バッファーに担体分子(BSAまたはゼラチン)が必要な場合があります。ガラス製品への高い非特異的結合等。 | |
| 適していないガラス製品またはプレート | 一部のプラスチック製のプレート、チューブ、またはチップは、放射性/非標識リガンドの非特異的結合の原因となる可能性があります。これらを実験前に確認しておきます。 | |
| 適していない洗浄バッファー | バッファー組成を確認し、これらがアッセイに最適化されていることを確認してください。 | |
| 溶液の不安定性 | 新たに調製したリガンドまたは化合物を使用してみてください。別の放射性標識リガンドに切り替えるのも手です。 | |
| 操作/ピペッティングの問題 | 異なるサンプルまたは濃度間をピペッティングする際はチップを切り替えます。粘着性のリガンドの場合、新しいチップを溶液に入れてから1〜2回ピペッティングしてから移し替えます。この操作は、ピペットチップの内側をプレコートするのに役立ち、より多くのリガンドを添加することができます。 |















