| 文字サイズ: |
ラジオイムノアッセイ
目次
実験概要
主な準備物
実験の留意点
用語
アッセイの種類
測定結果からの計算方法
ヒント
引用文献
実験概要
ラジオイムノアッセイ(Ridioimmunoassay:RIA)は、抗体を使用してサンプル中の抗原(分析対象)の量を検出および定量することができます。このアッセイは通常、非常に感度が高く特異的です。
高親和性の抗体(Kd = 10-8~10-11 M)を使用すると、数pg程度の抗原を検出することが可能です。基本原理は競合的結合であり、放射性標識抗原が一定数の抗体または受容体結合部位に対して非放射性抗原と競合します。
標準溶液またはサンプル中に含まれる非標識抗原と、放射性標識抗原を一定量の抗体と反応させますが、非標識抗原の量が増加すると放射性標識抗原の抗体結合量が減少します。
例えば、125Iおよび3Hを利用するアッセイキットの場合、遊離抗原から抗体-抗原複合体を分離するために、一次抗体の免疫グロブリンに対する二次抗体を用いて抗体-抗原複合体を沈殿させるか、ポリエチレングリコールの添加による沈殿を行います。
遠心分離後、遊離抗原を含む上清をデカントし、抗体-抗原複合体を含むペレットをシンチレーションカウンタでカウントします。標準溶液の測定結果は、標準曲線を作成するために用いられます。

ラジオイムノアッセイの原理
放射性標識抗原Ag*を特異的な抗体Abに加えると、抗原抗体複合体Ag*Abが形成されます。サンプルまたは標準溶液からの非放射性標識の抗原Agも抗体に結合し、非放射性標識の抗原抗体複合体AgAbが形成されます。
ラジオイムノアッセイでは、放射性標識抗原Ag*の添加は一定量であり、サンプル中の非標識抗原の量が増えると、放射性標識抗原と競合し、非標識抗原-抗体複合体AgAbが増加します。
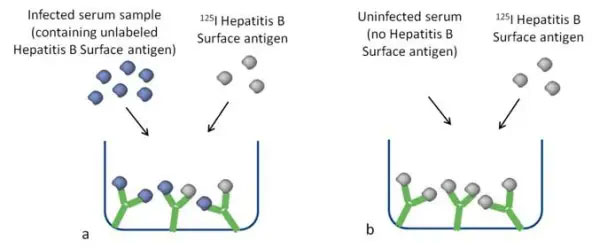
非標識抗原(この例ではHepatitis B Surface抗原)または放射性標識抗原と抗体の結合様式
非標識抗原の量が増えると、放射性標識抗原の結合数が少なくなります。非標識抗原は、標準溶液またはサンプルのいずれかに由来します。
図2. a)大量の抗原を含むサンプル。非放射性標識抗原は、チューブまたはウェル内の抗体へ競合的に結合します。
図2. b)少量の抗原を含むサンプル。抗体は放射性標識抗原と結合します。
主な準備物
アッセイバッファー
0.9%NaCl、0.05%アジ化ナトリウムを含む50 mMリン酸バッファー(pH 7)
(抗原が試験管等へ付着することを最小限に抑えるために、0.3%ウシ血清アルブミンを添加することも可能です。他の添加剤として、10 mM EDTAおよび/または0.5%Tween-20があります。)
125Iまたは3H標識抗原
放射性標識抗原の濃度を最適化する場合、まずは下記2つの用語を理解する必要があります。
比放射能
これは、放射性標識抗原の放射能量であり、単位はBq/mmolまたはBq/µgになります。この値から、アッセイの際の単位溶液量あたりの抗原の質量がわかります。
アッセイにおける放射性標識抗原の理想的な質量濃度は、使用される抗体希釈液に対する飽和濃度よりわずかに低い値となります。
理想的には、非標識抗原の非存在下で、放射性標識抗原の30〜60%を結合させる必要があります。これにより、最適なアッセイ感度が得られます。
比放射能の高い放射性標識抗原は、抗原結合アッセイに適しています。125I標識抗原のいくつかは、最大比放射能で提供されます(1つの125I標識部位がある場合は81.4 TBq / mmol、2つの場合は162.8 TBq/ mmolとなる)。これは、バイアル中の抗原のほぼすべての分子が放射性標識されていることを示しています。3H標識抗原の場合、740 GBq / mmolを超える比放射能を持つ製品を選択する必要があります。3Hあたりの最大理論比放射能は1,07 GBq / mmolです。この値を超える比放射能を持つ場合、抗原の各分子が少なくとも1つ以上の3Hを持っていることを示します。
放射能濃度
溶媒の単位体積あたりの放射能量で、通常はBq/mLで示されます。非特異的結合、ゼロスタンダード結合(サンプルなし、非標識抗原なしでの結合)等の計算に必要なため、重要な指標になります。
*ほとんどのRIAキットでは、放射性標識抗原の濃度は最適化されているため、アッセイバッファーで希釈を行い、アッセイチューブごとに適切な量を添加するだけです。
抗体(抗血清)
RIAキットの場合、抗体(抗血清)は、適切な検量線が作成できるような濃度になっています。非標識抗原が存在しない状態で、30〜60%の放射性標識抗原を抗体に結合させるには希釈が必要になります。
ゼロスタンダード結合(サンプルなし、非標識抗原なし)が検量線の範囲外にある場合、アッセイ結果が有効ではない可能性があります。
抗体(抗血清)の結合力と親和性(avidity and affinity)は、検量線の適切な濃度範囲とサンプルの濃度の決定に影響を与えます。そのため、キットの開発の際には抗体(抗血清)の選択が重要となっています。
アッセイ感度を最適化する場合、力価測定された抗体(抗血清)の希釈液を使用することで、30〜60%のゼロスタンダード結合が得られ、最適な検量線の中間点(EC50)が得られます。これは、市販のキットでは事前に決定されています。
標準溶液
ほとんどのRIAキットでは、標識なしのキャリブレーション用の標準溶液が提供されるので、それを用いて検量線作成のための一連の段階希釈溶液を準備します。
例えばRIAキットには、100 ng / mLの標準溶液が含まれている場合がありますが、以下のようにアッセイに適した検量線を作成するために段階希釈します。
キャリブレーション用の標準の段階希釈
| Suggested Dilution Scheme for 100 ng/mL stock Calibration Standard | ||
| Tube | Concentration (pg/0.1 mL)* | |
| a | 0.1 mL (100 µL) standard + 1.9 mL assay buffer | 500 |
| b | 0.4 mL of dilution a + 0.6 mL assay buffer | 200 |
| c | 0.4 mL of dilution b + 0.4 mL assay buffer | 100 |
| d | 0.4 mL of dilution c + 0.4 mL assay buffer | 50 |
| e | 0.4 mL of dilution d + 0.4 mL assay buffer | 25 |
| f | 0.4 mL of dilution e + 0.6 mL assay buffer | 10 |
| g | 0.4 mL of dilution f + 0.4 mL assay buffer | 5 |
| h | 0.4 mL of dilution g + 0.6 mL assay buffer | 2 |
*標準曲線には、bからhまでの希釈を使用する必要があります。
**標準溶液は、アッセイ当日に調製します。
沈殿試薬
沈殿試薬を使用すると、結合していない抗原と抗体から、結合した抗原抗体複合体を分離できます。50 mMリン酸緩衝液(pH 6.8)に16%ポリエチレングリコール(PEG 6000)および0.05%アジ化ナトリウムを含む溶液を添加します。あるいは、一次抗体の免疫グロブリンに対する二次抗体(rabbitの抗原を沈殿させるためのsheep anti-rabbit IgG抗体など)を使用することも可能です。
沈殿試薬には、二次抗体でコーティングされたSPAビーズまたは磁性粒子が含まれるものもあります。
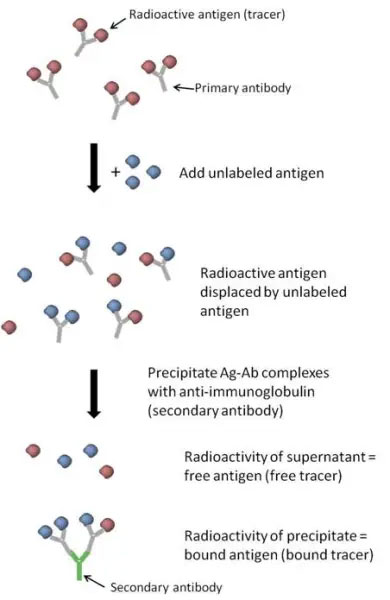
ラジオイムノアッセイの概要図
放射性抗原が抗体に添加され、続いて(サンプルまたは標準溶液の)非標識抗原が添加されます。形成された抗原-抗体複合体は、沈殿試薬を使用して沈殿させ、遊離している放射性標識抗原を分離します。
実験の留意点
放射性標識抗原を選択する際に以下の留意すべきいくつかの点があります。
非特異的結合:
疎水性の放射性標識抗原は、高い非特異的結合を示すことがあります。BSA、特定の塩または界面活性剤をアッセイバッファーに添加することにより、非特異的結合を減らすことができます。
放射性標識抗原がシラン処理されたバイアルに入っている場合(データシートに記載されていることがあるので参照してください)、抗原が疎水性であることを示している可能性があります。
高い放射化学純度:
理想的には、放射性標識抗原の放射化学純度が90%を超えている必要があります。放射化学純度は時間とともに低下します。
高い選択性:
放射性標識抗原が抗体に対して選択的であるほど、取得されるデータは良くなります。高い選択性は、放射性標識抗原が適切な抗体結合部位によって認識されることを示します。
安定性:
長期間にわたって放射性標識抗原を使用する場合は、安定性が影響する場合があります。125I標識抗原は通常、製造日から1〜2か月以内に使用する必要があります。
また、3H標識抗原は通常、製造日から3〜6か月以内に使用する必要があります。ただし、これには例外があり、その劣化率と製造日はデータシートに記載されていますので参照してください。
エネルギー:
3Hはβ線を放出します。そのため、シンチレーションカクテルを添加後にシンチレーションカウンタで測定できます。β線はシンチレータと相互作用して光子を生成します。125IはX線とγ線の両方を放出します。ガンマカウンタしか施設にない場合は、125I標識抗原を使用します。
用語
親和性(Affinity (potency):
抗原が抗体結合部位に結合する強さ。これは通常、平衡定数Kdとして表されます。Kd値が低いほど、親和性が高くなります。Kd値から非標識抗原の濃度を求めることができます。
特異性(Specificity):
特定の抗原に対する抗体結合部位の選択性
交差反応性(Cross-reactivity):
構造的に類似する抗原が抗体に結合することを指し、アッセイの阻害要因になります。
Kd:
抗体結合部位の50%が抗原によって占められている濃度。
IC50:
放射性抗原の半分を置換する競合抗原の濃度。これが検量線の中間点になります。
アッセイの種類
飽和アッセイ(Saturation assay)
ラジオイムノアッセイを最適化する際には、通常、飽和アッセイが行われます。この実験では、抗体または抗血清の量を一定に保ちながら、種々の濃度の放射性抗原の添加によって結合平衡を測定します。
飽和曲線を使用して、Bmax(受容体密度を示す最大結合量)とKdを決定できます。飽和レベルの約50〜60%の放射性標識抗原濃度とすると、アッセイで使用する適切な放射性標識抗原の量が得られます。
飽和曲線にはどの濃度の放射性標識抗原を使用すればよいですか?
一般的に、推定されるKdの1/5~5倍程度の濃度を選択することをお勧めします。テストする最大濃度は、Kdの10倍までとしておきます。
以下の図は、一定量(濃度)の受容体膜(10 µg / mL)を使用し、3H標識抗原であるシクロペンチル-1,3-ジプロピルキサンチンの濃度を増加させた飽和アッセイをグラフで示したものです。
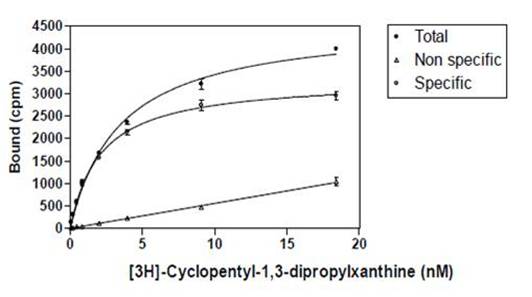
3H標識シクロペンチル-1,3-ジプロピルキサンチンの受容体への結合を示す飽和曲線
放射性抗原が一定の濃度の受容体に加えられています。
Total(全結合):非標識抗原が存在しない状態での放射性抗原の濃度の増加分をグラフにプロットしたもの。受容体への特異的結合と非特異的結合の両方が測定されたものです。
Non Specific(非特異的結合):過剰な非標識抗原存在下での放射性抗原の濃度の増加分をグラフにプロットしたもの。抗体以外の分子への放射性標識抗原の結合を測定します。
Specific(特異的結合):全結合から非特異的結合を差し引いたもの。抗体への特異的な結合を測定します。
競合アッセイ
標準溶液の非標識抗原、サンプル、さらに単一濃度の放射性標識抗原を添加し、それらと抗体との結合を測定します。
RIAのプロトコルの例
1. すべての試薬を室温に戻し、使用前に混合します。
2. 総カウント(Total)、非特異的結合(Non Specific)、標準溶液、およびサンプルについて、チューブにラベルを付けます(以下の表を参照)。
3. チューブを適切な試験管ラックに置きます。
4. 2〜8℃で一晩(16〜24時間)インキュベートします。
5. 総カウント(Total)を除くすべてのチューブに1 mLの冷やした沈殿試薬を加え、混合します。
6. 2〜8℃で20〜30分間インキュベートし、2〜8ºCで遠心します(1000-2000 x gで30分間)。
7. すべてのチューブ(Total Countsチューブを除く)からの上清を適切な放射性液体廃棄トレイにデカントします。
8. アッセイチューブの縁から残った溶液を吸水紙で吸い取ります(約1分間)。
9. アッセイチューブ(Total Countsを含む)に残っている放射能をカウントします。
ラジオイムノアッセイプロトコール用のチューブ
| Tube No. | Buffer | Standard | Samples | Tracer | Antibody | |
| Total Counts | 1-2 | -- | -- | -- | 100 | -- |
| Blank | 3-4 | 200 | -- | -- | 100 | -- |
| "0" Standard | 5-6 | 100 | -- | -- | 100 | 100 |
| Standards | 7-20 | -- | 100 | -- | 100 | 100 |
| Samples | 21,22, etc. | -- | -- | 100 | 100 | 100 |
*容量はすべてマイクロリットル(µL)。
競合的結合では、放射性抗原の濃度をどのように決定すればよいですか?
放射性抗原は、通常、Kd値以下の濃度にします。比放射能が低い場合は、Kd値を超える濃度でも使用できますが、飽和濃度以上であってはなりません。
測定結果からの計算方法
サンプル中の抗原の濃度は、標準曲線からの補間によって決定されます。次の方法をお勧めします(計算例については、表を参照してください)。
・チューブの各セット(replicate)で得られたカウントを平均します。
・すべての標準溶液(ゼロスタンダードを含む)とサンプルについて、それぞれの非特異的結合カウント(バックグラウンドカウント=Blank)を差し引き、平均NETカウント正味の計数率を計算します。
・次のように、各標準とサンプルの結合割合(%B / B0)を決定します。
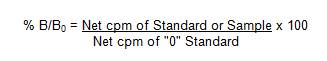
・%B / B0に対する添加された非標識抗原量をpgでプロットします。標準的なプロトコルを使用した標準曲線については、以下の図を参照してください。
・標準曲線からサンプル中の抗原の量を決定します。標準曲線は「pg」として表されるため、サンプルでは、元の濃度を決定するためにはそこから計算する必要があります。
*標準曲線の範囲を超える濃度のサンプルは、アッセイバッファーで希釈して再度アッセイする必要があります。
生データと処理済みデータ
| Tube | No. | CPM | Avg CPM | Net Avg CPM | %B/B0 |
| Total Counts | 1 | 14963 | |||
| 2 | 15563 | 15263 | |||
| Blank | 3 | 415 | |||
| 4 | 380 | 398 | |||
| "0" Standard | 5 | 8879 | |||
| 6 | 8673 | 8776 | 8378 | 100 | |
| 2 pg | 7 | 7701 | |||
| 8 | 7939 | 7820 | 7422 | 88.6 | |
| 5 pg | 9 | 6873 | |||
| 10 | 6886 | 6880 | 6482 | 77.4 | |
| 10 pg | 11 | 5632 | |||
| 12 | 5900 | 5766 | 5368 | 64.1 | |
| 25 pg | 13 | 4216 | |||
| 14 | 4256 | 4236 | 3838 | 45.8 | |
| 50 pg | 15 | 3082 | |||
| 16 | 2995 | 3039 | 2641 | 31.5 | |
| 100 pg | 17 | 2257 | |||
| 18 | 2003 | 2130 | 1732 | 20.7 | |
| 200 pg | 19 | 1491 | |||
| 20 | 1661 | 1576 | 1178 | 14.1 | |
| Sample | 21 | 5829 | |||
| 22 | 5919 | 5874 | 5476 | 65.4 |
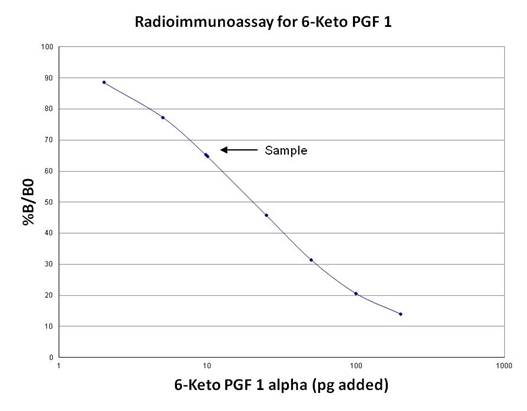
6-ケトPGF1の標準曲線
未知のサンプルの濃度は、曲線から補間されます。
ヒント
・総カウント、非特異的結合、ゼロスタンダード結合、標準曲線の形状(線形性など)が適切であることを確認してください。これらの要素のいずれかに異常がある場合、生データを調べるとわかります。
・ゼロスタンダードと標準曲線の最下点との間は、検出感度以下です。標準曲線の最下点以下のサンプルを測定する場合は、サンプルの濃縮が効果的かもしれません。
・もしくは、別の方法としてdelayed additionアッセイがあります。抗体と標準溶液もしくはサンプルを放射性抗原なしで3〜4時間インキュベートすることにより、アッセイの検出感度を高めることができます。最初のインキュベーションの後、放射性標識抗原を添加し、チューブを混合して、一晩インキュベートします。必要に応じて、より感度の高い抗体を使用してアッセイを最適化することもできます。
・アッセイ間のばらつきを防ぐために、一晩のインキュベーション時間など適切なインキュベーション時間を標準化してください。
・疎水性抗原は一般的に高い非特異的結合を示します。TweenまたはTriton X-100の添加で低減される可能性があります。
・高い放射化学的純度の放射性標識抗原を使用します(通常は90%を超える純度)
・選択性の高い抗体を使用します(構造的に類似した化合物に対する交差反応性が低いもの)。
・長期間にわたって放射性標識抗原を使用する必要がある場合、その安定性が実験結果に影響する場合があります。125I標識抗原は通常、製造日から1〜2か月以内に使用する必要があります。放射性同位元素が崩壊するにつれて、cpmの量は減少します。3H標識抗原は通常、製造日から3〜6か月以内に使用する必要があります。
引用文献
Radioimmunoassay. W.M. Hunter in Handbook of Experimental Immunology-Volume 1 Immunochemistry, D.M. Weir (Ed), Blackwell Scientific Publications, London 1978.
Radioimmunoassay. K.E. Kirkham & W. M. Hunter, Williams & Wilkins Co., Baltimore, MD 1971
Personal Communications- S. Richard Harris Ph.D, Dupont-NEN Biomedical Products.
Personal Communications- David Handfield and Scott Keohane, Perkin Elmer Life & Analytical Sciences.
Immunology - Dr Janis Kuby - W.H. Freeman & Co., NY 2007















