| 文字サイズ: |
IRMA 法による血中レニン量の測定
目次
実験理論
主な準備物
実験操作
操作手順プロトコル
結果のまとめ
考察への手引き
実験理論
ラジオアッセイとは、放射性同位元素で標識した抗原や抗体、又は生理活性物質等を用いて、これらが関与する特異的結合反応を行い、その結合結果から得られる放射能を測定することで物質の定量を行なう方法である。代表的なものとして、ラジオイムノアッセイ(放射免疫測定Radioimmunoassay,RIA)法とイムノラジオメトリックアッセイ(免疫放射定測定Immunoradiometric assay, IRMA)法がある。
RIA 法は抗原ー抗体反応をその測定原理とすることから、抗原、抗体および標識抗原による競合反応を利用する。これらの競合反応の結果、抗体と反応しなかった標識抗原(F)または標識抗原ー抗体結合体(B)のうちいずれかの放射能を測定することにより、非標識抗原(測定対象物であるインスリン)の定量が行える。
IRMA 法は抗原中の異なる2 か所にそれぞれ結合する2 種の抗体が用い、そのうち一方はポリスチレン(固相)などのビーズやチューブに固定、他方は125I などの放射性同位元素で標識されている。両抗体とも抗原の異なる箇所にいずれも抗原抗体反応でそれぞれ結合し、「固相結合抗体ー抗原ー標識抗体」複合体が作られる。測定試料中の抗原量が増えるに伴い標識抗体、及び固相の放射能量も増加することから、既知の標準抗原を用いて作製した標準曲線から抗原の定量を行なうことができる。なお、2 つの抗体で抗原をはさむことからサンドイッチ法とも呼ばれる。
主な準備物
実験器具
マイクロピペット(100 μL, 200μL ,1000μL)各1 本
チップ 必要数
チューブ 必要数
試験管立て 1 式
アスピレーター 1 台
実験機器
恒温震盪器 1 台
ガンマ・カウンタ 1 台
試薬の調製(レニンIRMA)
(1)各試薬は使用前に温室に戻し、泡立てないように混和し、液を均一にしてから用いる。
(2)検体は二重測定(duplicate)するので、各濃度、各検体について試験管2 本ずつを準備する。
実験操作
(1)チューブに①〜⑯番号を記入する。なお、①〜⑩は標準曲線作成用、⑪〜⑭は未知検体用、⑮及び⑯はTotal coun 測定用とする。
(2)①及び②には0 pg/mL の標準レニン溶液を200μL ずつ秤取する。以下③及び④に5pg/mL の標準レニン溶液と、順次、⑨及び⑩までのチューブに各標準レニン溶液を2本ずつ、200μL 秤取する。
(3)⑪〜⑭に未知検体1 と2 を2 本ずつ、200μL 秤取する。
(4)全てのチューブにヨウ化レニン(125I)を100 μL ずつ加える。
(5)①〜⑭にレニン抗体ビーズを1 個ずつ加える。
(6)①〜⑭のチューブにキャップをつけ、恒温震盪器(200〜240 rpm)で室温で3 時間インキュベートする。
(7)①〜⑭のチューブの反応液を吸引除去、洗浄液(精製水)2 mL を入れ、チューブ内壁とビーズを洗浄し、洗浄液を吸引除去する。この操作を、さらに2 回繰り返す。
(8)全ての放射能(cpm)を、γ カウンタを用いて測定(1 分間)する。
(9)各標準レニン溶液の平均計数率(B cpm)から0 pg/mL の平均計数率(B0 cpm)を差し引き、Total count の平均計数率(T)に対する比を計算する(表1~3)。計数率比(%)= {(BーB0)/T}×100
(10)両対数グラフ用紙を用いて、レニン濃度(pg/mL)を横軸に。各標準レニン溶液の計数率比(%)を縦軸にとり標準曲線を作成する(図1)。この標準曲線を用いて、未知検体の計数率比からレニン濃度を読み取る。
操作手順プロトコール
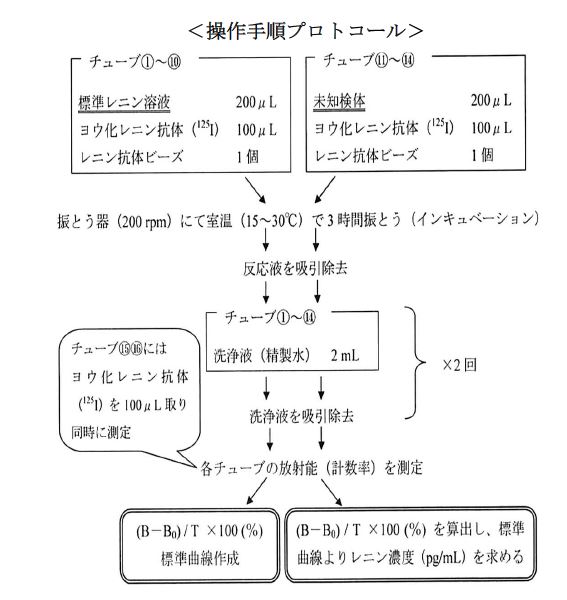
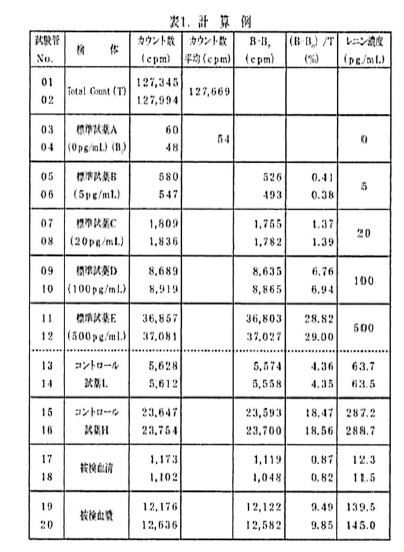
表1. 計算例
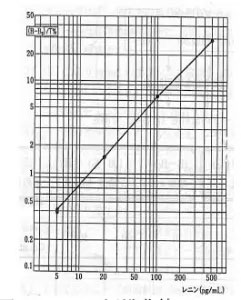
図1 レニン標準曲線
(表1 計算例をもとに作成した例)
*参考正常値
随時:3.2〜36.3(pg/mL)
臥位:2.5〜21.4(pg/mL)
立位:3.6〜63.7(pg/mL)
結果のまとめ
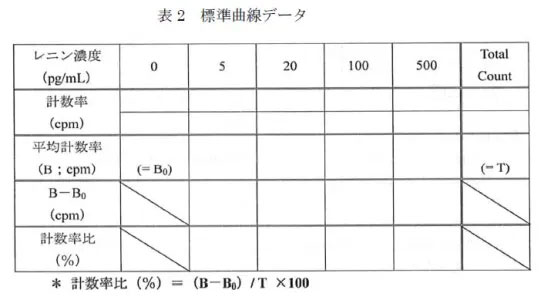
表2. 標準曲線データ
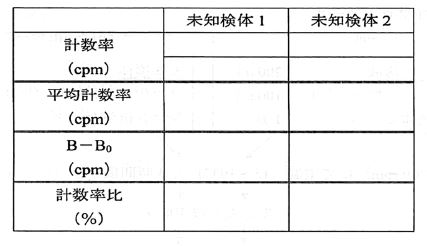
表3. 未知検体データ
考察への手引き
(1)IRMA 法とRIA 法との相違点をまとめる。
(2)レニンについて生理作用や疾患との関係を調べて記述する。
(3)参考正常値から、未知検体はどのような患者かを推定する。















