| 文字サイズ: |
FlashPlateアッセイ for 35S-γ-GTP結合
目次
実験概要
主な準備物
35S-γ-GTP製品
プロトコル
アッセイの最適化
その他の情報
ヒントとよくある質問
データ分析
引用文献
実験概要
FlashPlateは、プレートにシンチレータが埋め込まれている特殊なプレートです。FlashPlateフォーマットでは、細胞膜はFlashPlateのウェルの底と側面に結合しています。
GPCRが活性化されると、35S-γ-GTPが細胞膜に結合します。 これにより、放射性物質がFlashPlateの底、側面に接近します。
放射性物質がウェルの端に近い場合、35Sからのβエネルギーがシンチレータと相互作用し、シグナルを生成します。未結合の35S-γ- GTPは溶液中に浮遊し、ウェルに接近しないためシグナルを生成しません。
FlashPlateのウェルに細胞膜を結合させる方法は2つあります。基本的なFlashPlates(コーティングなし)を使用して、細胞膜をウェルに直接コーティングできます。FlashPlateウェルの内部は、ポリスチレンベースのシンチレータでコーティングされています。アゴニストによるGPCRへの結合は、GDPとGTPの交換につながります。そのため、Gαβγ複合体のGαに結合していたGDPは解離し、35S-γ-GTPに置き換えられます。
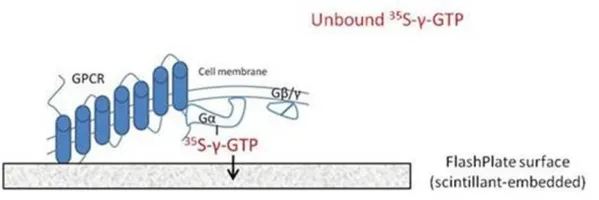
FlashPlateアッセイ
主な準備物
・FlashPlate
・目的の受容体を発現する細胞膜
・35S-γ-GTP
・非標識の非加水分解性GTP(非特異的結合の測定のため)
・GDP、アゴニスト、アンタゴニスト、および必要に応じた試験化合物
・検出機器
35S-γ-GTP製品
| Product number | Radioactive Concentration | Specific activity | Buffer |
| NEG030H | 462.5 MBq/mL | 46.2TBq/mmol | 10 mM Tricine pH 7.6, 10 mM DTT |
| NEG030X | 37 MBq/mL | 46.2TBq/mmol | 10 mM Tricine pH 7.6, 10 mM DTT |
プロトコル
h5-HT1B受容体が発現している細胞膜が結合したFlashPlateアッセイのサンプルプロトコルを示します。
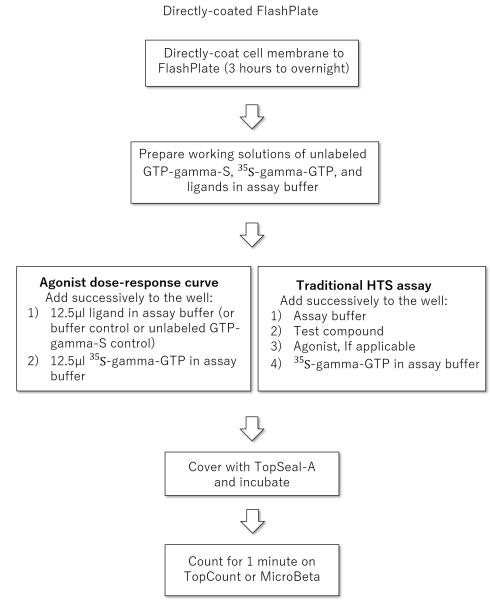
FlashPlateアッセイのフロー
Direct plate-coating protocol(FlashPlate(コーティングなし)に細胞膜を直接コーティングするためのプロトコルの例):
h5-HT1B受容体を発現するCHO細胞の細胞膜を、2.5 mM CaCl2と1 mM MgCl2を含む25 mM HEPESバッファー(pH 7.4)で目的とする濃度に希釈します。
希釈した受容体の懸濁液(230μl)をFlashPlateマイクロプレートの各ウェルにピペットで移し、プレートを4℃で800 x g、10分間遠心分離します。
上澄みを除去し、プレートを4℃で一晩インキュベートします(3時間でも可能)。
使用前に、上記のHEPESバッファーに溶解した0.5% BSA 250μlを各ウェルに加え、室温で30分間放置した後、プレートを吸引して乾燥させ、非特異的結合部位をブロックします。
アッセイの最適化
・各試薬の濃度:0-10μM(GDP)、1-10 mM (MgCl2)、0-100 mM (NaCl)、および3-100μg/ mL(サポニン)からテストすることをお勧めします。
・インキュベーション時間:Direct plate-coating protocolを使用した実験では、吸引して30分後に反応を停止させたところ、すぐに読み取りが可能でしたので参考にしてください。
・アゴニストの用量反応曲線およびその他のアッセイも必要になる場合があります。
その他の情報
・NIHによるGTP結合アッセイのガイドはこちらからご参照ください。
ヒントとよくある質問
・SPAアッセイは、Gi共役型GPCRで最もよく機能します。GsまたはGqタンパク質に対するGiの発現レベル、およびGTPに対するこれらGタンパク質の交換率の両方が影響し、通常GsおよびGq共役型受容体では非常に低いアッセイ感度となります。
・SPAアッセイは、アッセイバッファー中のGDP濃度、35S-γ-GTP、Mg2 +の濃度に特に影響を受けます。
・アッセイの際には、通常状態でのGTP結合レベルを決定するための非アゴニストコントロールと、非特異的結合コントロール(非標識の非加水分解性GTPを使用)を含めること。
・ウェルの中心に滴下することをお勧めします。ウェルの側面に沿って滴下すると、少量で作業するときに「トラッキング」と呼ばれる現象が発生し、液滴がウェルの側面に付着する可能性があります。この液滴が残りの溶液と混合しないため、ばらつきが大きくなり、カウントが減少します。
・細胞膜を直接FlashPlateに結合させる場合は、ピペッティング中にウェルの底を傷つけないように注意してください。カウントが減少します。
・化合物を添加した後は必ずチップを変えてください。キャリーオーバーにより測定結果に影響します。
・放射性リガンドを添加した後、プレートを覆い、暗所でインキュベートします。プレートが光にさらされると、シンチレータが励起する可能性があります。これにより、バックグラウンドノイズが増加し、結果に影響を与えます。
・インキュベーション中にプレートを振ったり回転させたりしないでください。プレートを回転または振ると、FlashPlateウェルの底にある液体がこぼれる可能性があります。したがって、シール等で覆われたFlashPlateを平らな面に置き、円を描くように動かして(2回転で十分)、静かに液体を混ぜることをお勧めします。多数のマイクロプレートを使用している場合は、それらを積み重ねてから、円を描くようにゆっくりと動かします。
・検出器を複数有する機器は正規化(ノーマライズ)することが重要です。機器が正規化されていない場合は、測定値の変動が大きくなります。個々の検出器は、最適に読み取るために正規化される必要があります。
・FlashPlateアッセイを初めて実施するときには、検出器のバックグラウンド除去を実行することが重要です。除去する際はアッセイに使用するものと同じタイプのプレートで行います。バックグラウンド除去により、より良いS/B(シグナル/バックグラウンド)値が得られます。
・非常に乾燥した環境で作業する場合は、静電気に注意してください。静電気は、カウントの異常値を引き起こします。たとえば、予想される値として300〜400 cpm程度のアッセイで、静電気が発生して10,000 cpmと計測されたことがありました。もし問題が発生した場合は、プレートを再度読み取るか、湿ったキムワイプでプレートの下部または側面を拭いてプレートを再度読み取ります。
データ分析
詳細はこちらをご覧ください。















