| 文字サイズ: |
Filtrationアッセイ for 35S-γ-GTP結合
目次
実験概要
主な準備物
35S-γ-GTP製品
プロトコル概要
アッセイの最適化ために
その他の情報
ヒント
データ分析
引用
実験概要
Filtrationアッセイでは、初めに35S-γ-GTPをアッセイプレート内の受容体を含む細胞膜へ結合させます。
インキュベーション後、フィルターマットまたはUniFilterプレートでろ過します。その後、フィルターを洗浄し、未結合の35S-γ-GTPを除去します。
ろ過および洗浄ステップでは、セルハーベスターまたはバキュームマニホールドを使用します。その後、フィルターマットまたはUniFilterプレートを乾燥させ、シンチレーションカクテルを加えてから、検出器で読み取ります
他のアッセイ法でバックグラウンドが高くなる問題を回避するために、この方法が用いられる場合があります。
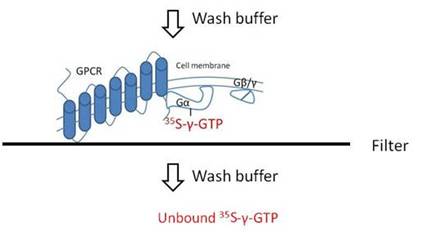
フィルタープレートGTP結合アッセイ
主な準備物
セルハーベスター、UniFilterプレートを使用する場合
・目的の受容体を発現する細胞膜
・35S-γ-GTP
・非標識の非加水分解性GTP(非特異的結合の測定のため)
・GDP、アゴニスト、アンタゴニスト、必要に応じた試験化合物
・バインディングアッセイ用のマイクロプレート
・UniFilterプレート
・結合バッファー
・洗浄バッファー
・シンチレーションカクテル
・セルハーベスター
・検出器
フィルターマット、真空マニホールドを使用する場合
・目的の受容体を発現する細胞膜
・35S-γ-GTP
・非標識の非加水分解性GTP(非特異的結合の測定のため)
・GDP、アゴニスト、アンタゴニスト、必要に応じた試験化合物
・バインディングアッセイ用のマイクロプレート
・フィルターマット
・結合バッファー
・洗浄バッファー
・シンチレーションカクテル
・真空マニホールドまたはセルハーベスター
・検出器
35S-γ-GTP製品
| Product number | Radioactive Concentration | Specific activity | Buffer |
| NEG030H | 462.5 MBq/mL | 46.2TBq/mmol | 10 mM Tricine pH 7.6, 10 mM DTT |
| NEG030X | 37 MBq /mL | 46.2 TBq /mmol | 10 mM Tricine pH 7.6, 10 mM DTT |
プロトコル概要
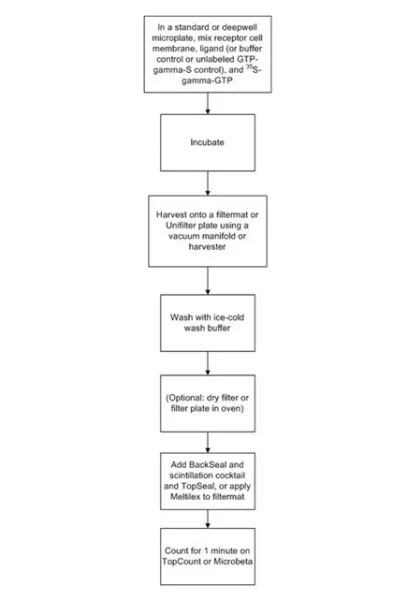
アッセイの最適化
・細胞膜量:96ウェル形式では5〜50μg/ウェル
・結合バッファー:0-10μM(GDP)、1-10 mM(MgCl2)、0-100 mM(NaCl)、3-100μg/ mL(サポニン)でまずはテストすることをお勧めします。
・インキュベーション時間:30分-1時間
・洗浄バッファーの最適化、洗浄ステップ数の工夫
・コントロール化合物の用量反応曲線の評価
その他の情報
・5-HT1B受容体を発現する細胞膜でのFiltrationアッセイについてはこちらから。(要リンク先)
・35S-γ-GTPアッセイのガイドについてはこちらから。(要リンク先)
ヒント
・SPAアッセイは、Gi共役型GPCRで最もよく機能します。GsまたはGqタンパク質に対するGiの発現レベル、およびGTPに対するこれらGタンパク質の交換率の両方が影響し、通常GsおよびGq共役型受容体では非常に低いアッセイ感度となります。
・35S-γ-GTPアッセイは、アッセイバッファー中のGDP、35S-γ-GTP、Mg2 +の濃度に特に影響を受けます。
・35S-γ-GTPアッセイ用のフィルターは、PEI(ポリエチレンイミン)で処理しないでください。これにより、非特異的結合が増加します。
・アッセイ系を構築する際には、通常状態でのGTP結合レベルを決定するためのアゴニスト非添加のコントロール、非特異的結合コントロールを含めることをお勧めします 。
データ分析
詳細はこちらをご覧ください。















