| 文字サイズ: |
アセチルCoAを使用したアセチル化アッセイ
目次
実験概要
主な準備物
製品とカタログ番号
プロトコル概要
引用文献
実験のヒント
実験概要
3Hおよび14C-アセチルCoAは、ヒストンおよびその他のタンパク質のin vitroアセチル化を研究するために使用される放射性標識基質です。
アセチル化は通常、タンパク質やペプチドのN末端、またはタンパク質内のリジン残基で起こります。また、アセチル化の実験は、3H標識酢酸ナトリウムを使用することも可能です。脱アセチル化アッセイ用の放射性基質は、放射性標識酢酸塩を使用します。
ヒストンのリジン残基のアセチル化と脱アセチル化は、エピジェネティックな調節に重要な役割を果たします。アセチル化は負電荷を与え、ヒストンの正電荷を中和し、負に帯電したDNAの結合を減らします。これによりクロマチン構造が緩み、転写に関わる分子群がDNAにアクセスできるようになります。ヒストンのアセチル化状態は、2つの酵素(ヒストンアセチルトランスフェラーゼ(HAT)とヒストンデアセチラーゼ(HDAC))によってバランスが保たれています。HATおよびHDACは、ヒストンタンパク質以外のものをアセチル化および脱アセチル化することもできます。
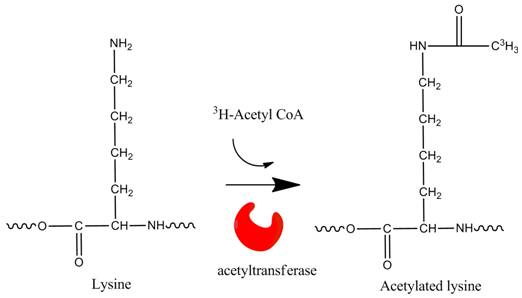
アセチル-CoAの標識を使用したアセチル化
主な準備物
標準的なin vitroアセチル化アッセイ
・3Hまたは14C標識アセチルCoA
・基質
・アセチルトランスフェラーゼ酵素
・非標識アセチルCoA*
・ポリアクリルアミドゲル電気泳動用のゲル、バッファー**
・オートラジオグラフィーフィルムと現像液
*非標識のアセチルCoAを使用して、放射性標識化合物の比放射能を低下させ、反応中のアセチルCoAのモル濃度を増加させることができます。
**ゲル電気泳動以外にも、Whatman P81ペーパーで分離し、カクテルを加えた後、液体シンチレーションカウンタで測定も可能です。
ハイスループットFlashPlate in vitroアセチル化アッセイ
・3Hまたは14C標識アセチルCoA
・FlashPlate*またはストレプトアビジンコーティングされたFlashPlate
・基質
・アセチルトランスフェラーゼ酵素(HAT)
・非標識アセチルCoA
*FlashPlateの代替として、SPAストレプトアビジンコーティングビーズも利用可能
細胞ベースのアセチル化アッセイ
・3Hまたは14C標識酢酸ナトリウム
・細胞
・培養液
・洗浄バッファー
・精製、溶解または抽出試薬
・液体シンチレーションカウンタ、オートラジオグラフィー、ホスホイメージャー用の試薬
製品とカタログ番号
| Chemical | Radioisotope | Labeling | Specific activity (/mmol) |
Rad. conc. (/mL) |
Solvent | Storage | Cat. number |
| Acetyl-CoA | 3H | acetyl-1 | 37 - 370 GBq | 3.7 MBq | Packaged under nitrogen in 0.01 M sodium acetate pH 5 | -20°C | NET290 |
| 14C | acetyl-1 | 1.48 - 2.22 GBq | 740 kBq | Packaged under nitrogen in 0.01 M sodium acetate pH 5 | -20°C | NEC313 | |
| Sodium acetate (acetic acid, sodium salt) | 14C | (position 1) | 1.85 - 2.29 GBq | 7.4 MBq | Steri-packaged, aqueous solution | 2-8°C | NEC084A |
| (position 1) | 1.67 - 2.22 GBq | 37 MBq | Ethanol | 2-8°C | NEC084H | ||
| (positions 1,2) | 1.67 - 2.22 GBq | 3.7 MBq | Ethanol | -20°C | NEC553 | ||
| (position 2) | 1.67 - 2.22 GBq | 37 MBq | Ethanol | 2-8°C | NEC085H |
上記の表から放射化学物質を選択するために
化合物:
放射性標識アセチルCoAは酵素アッセイなどの生化学的アッセイに、放射性標識された酢酸ナトリウムは、細胞ベースのアッセイに使用されます。
放射性同位元素:
14Cまたは3Hのいずれかをアセチル化アッセイに使用します。14Cは3Hに比べてエネルギーが高いため、14Cは、液体シンチレーション計測においても3Hと比較して効率が高くなります。
溶媒:
エタノールが添加されている放射性標識化合物はより安定しています。
エタノールは細胞毒性を示す可能性があるため、細胞標識実験では、使用前にエタノールを蒸発させる必要がある場合があります。
比放射能:
比放射能が高いほど、アセチルCoAまたは酢酸分子あたりの放射能量が多くなります。
プロトコル概要


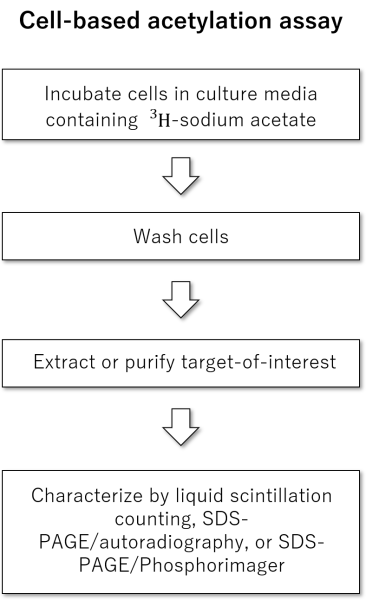
引用文献
標準的なアセチル化アッセイ
FlashPlateを用いたアセチル化アッセイ
細胞ベースのアセチル化アッセイ
実験のヒント
これまでの文献は、ヒストンがFlashPlateの表面に付着する可能性があることを示唆しています。したがって、FlashPlateを用いる場合は、基質、3H標識アセチルCoA、酵素を一度に混合し、インキュベートしてから測定するオプションがあります。この場合、FlashPlateのプレコーティングは必要ありません。
アセチルCoAは不安定ですので、加水分解を防ぐことも必要になります。また、非標識アセチル-CoAの調製は粉末からフレッシュなものを使用するのがよいでしょう。















