| 文字サイズ: |
チミジン取り込みアッセイ
目次
実験概要
主な準備物
製品とカタログ番号
チミジンの選択
プロトコル概要
CytoStar-Tプレート(384ウェル)を用いたプロトコル
引用文献
実験概要
チミジン取り込みアッセイによる細胞増殖試験は、リンパ球の増殖を刺激または阻害する天然・合成化合物の能力を評価するために、免疫学、癌、幹細胞、および創薬研究で頻繁に使用されます。
細胞増殖アッセイは、細胞分裂中に生成されたDNAの複製鎖へのDNAヌクレオシドである3H-または14C-チミジンの取り込みを測定します。
細胞培養はマイクロプレートで行われ、放射性標識DNAはセルハーベスターにより捕捉され、液体シンチレーションカウンタにより計測されます(Filtrationフォーマット)。
また、Cytostar-Tプレートを使用することも可能です(Cytostar-Tフォーマット)。これには、ろ過やシンチレーションカクテルの添加は必要ありません。
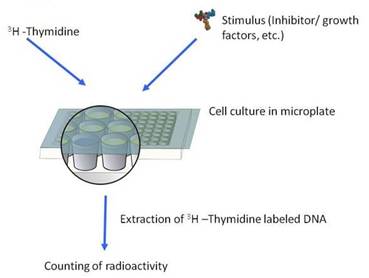
チミジン取り込みアッセイ
主な準備物
Filtrationフォーマット
・放射性標識チミジン
・細胞培養用のマイクロプレート
・UniFilterプレートまたはFiltermat
・セルハーベスター
・刺激因子
Cytostar-Tフォーマット
・Cytostar-Tプレート
・放射性標識チミジン
・刺激因子
製品とカタログ番号
| 応用 | 化合物 | specific activity(/mmol) | Rad. conc. (GBq/mL) | Packaging buffer | 保存温度 | Notes | カタログ番号 |
| DNA増殖 | Thymidine, [methyl-3H] | 74 GBq | 37 | Steri-packaged, aqueous solution | 5°C | 1ヶ月以内の使用を推奨します | NET027A |
| 248 GBq | 37 | Steri-packaged, aqueous solution | 5°C | 1ヶ月以内の使用を推奨します | NET027 | ||
| 740 GBq | 37 | Steri-packaged, aqueous solution | 5°C | 1ヶ月以内の使用を推奨します | NET027X | ||
| 740 GBq | 37 | 70% ethanol | -20°C | NET027E | |||
| 851-999 GBq | 37 | 10% ethanol | 5°C | NET027L | |||
| 1.48-2.22 TBq | 37 | 2% ethanol | 5°C | NET027W | |||
| 2.59-3.33 TBq | 37 | Steri-packaged, aqueous solution | 5°C | 1ヶ月以内の使用を推奨します | NET027Z | ||
| Total nucleic acid proliferation | Thymidine, [2-14C] | >1.85 TBq | 3.7 | Steri-packaged, aqueous solution | 5°C | NEC156 | |
| Thymidine, [6-3H] | >370 GBq | 37 | Steri-packaged, aqueous solution | 5°C | NET355 | ||
| DNA probe labeling | Deoxythymidine triphosphate, [methyl-3H] | 370-925 GBq | 37 | 50% ethanol | -20°C | NET221H | |
| 2.59-3.33 TBq | 37 | 50% ethanol | -20°C | NET221X | |||
| 2.59-3.33 TBq | 92.5 | 10 mM Tricine buffer pH 7.6 | -80°C | NET221A |
チミジンの選択
以下にチミジンの選択のためのヒントを示します。
トータル、またはDNAのみの標識:
チミジンはDNAとRNAの両方を標識します。しかし、3H標識メチルチミジン(メチル基に標識したチミジン)はDNAのみを標識します。
安定性or毒性:
エタノールを含む製品は保存期間が長くなりますが、細胞毒性を示す場合があります。一方でエタノールを含まない製品は毒性が低くなりますが、有効期間は短くなります。
使いやすさ:
特定の数値の比放射能となっている製品の場合は、毎回同じ量を実験に使用できるので簡便です。
一方で、比放射能が変動する製品の場合は、高いシグナルが得られますが、使用量を都度計算する必要があります。
シグナルor安全性:
比放射能が高いとシグナルが高くなりますが、保管中の安定性は低くなります。
増殖試験orプローブ標識:
チミジンとメチルチミジンは細胞増殖試験に使用され、チミジン三リン酸(Deoxythymidine triphosphate)は細胞に取り込まれないので、プローブの標識用に使用されます。
プロトコル概要
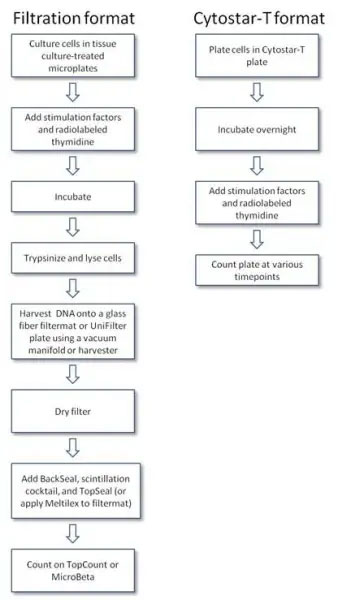
CytoStar-Tプレート(384ウェル)を用いたプロトコル
・162 cm2のフラスコで、5%CO2、37℃で細胞を増殖させ、サブコンフルエントな状態まで培養します。指数関数的に増殖している細胞は、最大のチミジン取り込みを示します。
・トリプシン処理によって細胞を剥がし、得られた懸濁液中の細胞数を計算します。
・懸濁液を播種密度に希釈し、40μL/ウェルを分注し、一晩インキュベートします。
・ウェルから培地を除去し、50μL /ウェルのPBSで洗浄します。14C標識メチルチミジンを培地で23.13 kBq/ mLに希釈します。希釈液80μLをウェルに加え、最終濃度を1.85 kBq/ mLにします。
・バックグラウンドカウント用のコントロールウェルの培地に14C標識メチルチミジンを添加します。
・透明なプラスチックプレートシールでプレートを覆い、プレートを測定します。
・プレートシールを慎重に取り外し、プレートの蓋と交換します。測定したプレートをインキュベーターに戻します。プレートを適切な間隔で測定します(例:24時間~72時間ごとに測定)。
・細胞の増殖と形態について顕微鏡下で定期的に確認してください。
オプション
・Cytostar-Tのシグナルは細胞密度の影響を受けるため、細胞数をカウントをします。
・実験の終了時に、細胞を液体シンチレーションカウンターで計測し、取り込みを確認することも可能です。















