| 文字サイズ: |
CATレポーター遺伝子アッセイ
目次
実験概要
主な準備物
プロトコル概要
引用文献
ヒントとよくある質問
実験概要
クロラムフェニコールアセチルトランスフェラーゼ(chloramphenicol acetyltransferase, CAT)レポーター遺伝子アッセイは、遺伝子導入された細胞におけるプロモーター遺伝子の発現を評価するための方法です。このアッセイにおいて、標的プロモーター配列が、動物細胞には存在しない細菌のCAT酵素をコードするDNA配列に融合されます。この酵素は、主にクロラムフェニコールのアシル化を触媒します。生成されたアセチル-クロラムフェニコール(AcCAM)を定量することにより、プロモーターの活性を測定できます。
以下で紹介するCATアッセイは、標識基質として14Cまたは3HアセチルコエンザイムAを使用し、二相分離法を利用します。
この方法では、CAT反応溶液(水相)をシンチレーションバイアル内で直接調製し、すぐに5 mLのカウント用の非水溶性サンプル測定用カクテルを有機相として上に重ねます。反応によって生成された14Cまたは3H AcCAMは、時間の経過とともに直線的にカクテルの有機相に拡散していきます。バイアルを直接計測器にセットし、バイアル内の二相反応ミックスを液体シンチレーションカウンタでカウントすることで、CAT活性を反映した定量データが得られます。酵素反応の速度は、cpm/minによって決定され、反応溶液中のCATの濃度に比例します。
この方法では、抽出操作やTLCオートラジオグラフィーは不要です。さらに、エンドポイントのアッセイと異なり、データを経時的に取得できます。また、他の利点としては、供給される14Cまたは3HアセチルコエンザイムAの比放射能と放射化学濃度が一定になっており、アッセイで直接使用できるように事前調整されています。そのため、追加での濃度調整操作は必要ありませんので、アッセイ間のばらつきもありません。
主な準備物
・14Cまたは3HアセチルコエンザイムA
・シンチレーションカクテル
・ガラスバイアル
・クロラムフェニコール
・E.coliクロラムフェニコールアセチルトランスフェラーゼ
・CATアッセイバッファー(100 mM Trisバッファー、pH 7.8)
・液体シンチレーションカウンタ
プロトコル概要
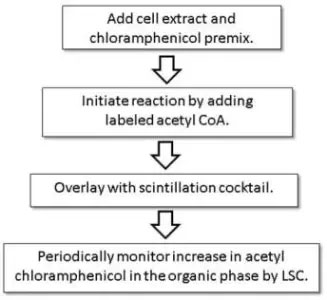
CATワークフロー
・各7 mLガラスバイアル中のCATアッセイバッファー(100 mM Trisバッファー、pH 7.8)に50μLの細胞抽出物またはCAT酵素コントロールを加えます。
・ここに1.25 mMクロラムフェニコールを含むプレミックス200μLを追加します。
・3.7kBqの14CアセチルコエンザイムAまたは18.5kBqの3HアセチルコエンザイムAを含む放射性標識基質を、22.5μLの1 mM非標識アセチルコエンザイムAに加えて反応を開始します。これらの添加により、0.1 mMの最終濃度のアセチルCoAが得られます。
・シンチレーションカクテルを添加します。
・室温でインキュベートします。
・液体シンチレーションカウンタでバイアルを順番にカウントします。バックグラウンドを超えるカウントが得られた任意の時点でアッセイを終了できますが、最終的な実験結果は1〜2時間で取得できます。
・各反応のcpm対時間をプロットします。
・コントロール曲線との比較によりCAT酵素活性を決定します。データはcpm/minとして表されます。
引用文献
ヒントとよくある質問
ヒント
・経時的なデータを取得するには、CAT反応の開始直後にシンチレーションカクテルをバイアルに添加する必要があります。
・細胞株によっては、細胞抽出物中の反応を干渉させるアシラーゼが含まれているので、それを失活させるために70°C、15分で熱処理が必要な場合があります。
よくある質問
サンプルを振ったり、ボルテックスする必要がありますか?
実験結果の直線性と再現性のために、2つの相の混合を避ける必要があります。サンプルを振り混ぜたり、ボルテックスしたりすると、水相が分散します。サンプルをカウントするまでに、完全な相分離が起こるまで十分な時間が必要です。
室温以外の温度でインキュベーションできますか?
反応を加速させる場合は、37°Cでのインキュベーションが可能です。
アッセイの感度はどのくらいですか?
185kBqの3HアセチルCoAを使用した実験では、CATレベルが0.0025ユニットまで直線性が保たれます。















