| 文字サイズ: |
REA 法によるアンギオテンシン転換酵素(ACE)の活性測定
目次
実験目的
Radioenzymatic assay(REA)は、トレーサ法を利用した酵素活性測定法の一つである。
ある酵素の基質として標識化合物を用い、標識された部分を含む生成物を適当な方法で分取し、その放射能を検出することにより、その酵素の活性を測定する。本実習では、血圧の制御において重要な役割を担っているアンギオテンシン転換酵素(ACE)の活性測定を通じて、REA の原理を学ぶ。
実験原理
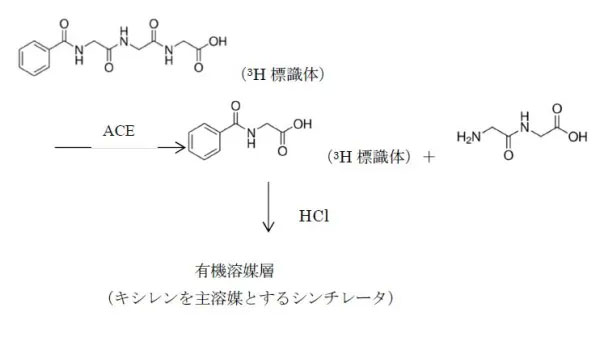
ACE は、アンギオテンシンⅠからアンギオテンシンⅡへの変換反応を触媒する酵素である。この ACE は合成基質である 3H-hippuryl-glycyl-glycine(別名:Benzoyl-glycyl-glycylglycine)の 3H-hippuric acid(別名:馬尿酸)と glycylglycine dipeptide への分解反応をも触媒できる。
検体をこの標識化合物である合成基質と反応させると、検体中の ACE が上記の反応を触媒し、標識された生成物 3H-hippuric acid が産生される。
酵素反応の終了後、塩酸酸性下でキシレンを主要溶媒として調製したシンチレータを加えると、生成物3H-hippuric acid は有機溶媒層(シンチレータ層)へと移行し、基質である3H-hippuryl-glycyl-glycine と分離される。
その結果、生成物である 3H-hippuric acid 由来の β-線のみがシンチレータを励起することとなり、生成物の放射能だけが検出され、得られた計数値より検体中の ACE 活性を測定することができる。
主な準備物
試薬
ACE Direct REA kit(188 kBq、100 回分/キット, ㈱セティ)、キシレン(シンチレータ調製用)、酢酸エチル(シンチレータ調製用)
使用器具・機器
アッセイチューブ(スクリューキャップの付いた 2 mL 用のポリプロピレンチューブ)、シンチレータ調製用の遮光ガラス瓶(150~200 mL)、ボルテックスミキサー、液体シンチレーション検出器
実験操作
(1)アッセイチューブをブランク用 2 本、校正試料用 2 本、コントロール用 2 本の合計 6本を用意する。さらに検体用として 1 検体につき 2 本のチューブを用意する。
(2)各々のチューブに 10 μl ずつの該当する試料(ブランク、校正試料、コントロール、検体)を添加する。
(3)100 μl のトレーサ液(3H 標識化合物を含む基質溶液)を添加する。
(4)37℃の恒温水槽中で 60 分間インキュベーションする。
(5)50 μl の 1M 塩酸溶液を添加し、ボルテックスミキサーで撹拌する。
(6)1.5 mL のシンチレータを添加し、5 秒間ボルテックスミキサーで撹拌する。
(7)チューブ内の溶液をシンチレーションバイアルに移し、1 時間以上室温で放置後、液体シンチレーション計数器で放射能を測定(測定時間 5 分)し、各試料の計数値を記録する。
注意点
・カウントを減少させてしまうため、チューブおよびキャップにラベルを貼らないこと。
・ブランク、校正試料、コントロールおよびシンチレータはキットのマニュアルに従って調製すること。
データ処理
(1)各試料 2 本の計数値の平均値を各々求める。
(2)コントロール、校正試料または検体の平均計数値からブランクの平均計数値を引き算し、各々の正味の計数値を求める。
(3)(2)で得られた各正味の計数値および校正試料の公称 ACE 活性(各キットに記載)を下記の式に代入し、コントロールおよび検体の ACE 活性を求める。

検体の準備についての注意
・血液凝固阻害剤である EDTA などは ACE 活性を阻害するため、実験動物から血清を得る際には血液凝固阻害剤は使用せず、採血した血液を遠心管に入れ、室温で 2~3 時間放置後、低温で遠心し、上清の血清を回収する。
・回収した血清を 5 日以内に使用しない場合は、-20℃以下で保管する。
・カプトプリル(ACE 阻害剤)を投与した実験動物から採取した血清を検体とする場合は、4 時間以内に行う。すぐに実験できない場合は、-70℃以下で保管し、出来るだけ早くアッセイに供与する。
考察の手引き
(1)分離操作なく生成物だけの放射能が測定できる理由を、基質と生成物の化学構造から説明できるか考察する。
(2)他の放射性同位元素で標識された、例えば 32P 標識の基質を用いた全く同じ操作の実験系があった場合、酵素活性は測定できるか、なにか問題点はないかを β-線のエネルギーの違いを観点にして考察する。















